(Flüssigkeiten oder Gasen)
Den „Auftrieb” in Fluiden kann man sehr gut mithilfe des Archimedischen Prinzips beschreiben. Hierzu betrachtet man der Einfachheit halber eine Flüssigkeit. Zunächst ist diese Flüssigkeit in einem Behälter im Gleichgewicht. Sie verhält sich ruhig unter dem Einfluss der Schwerkraft. Untersucht man mitten im Behälter ein kleines Flüssigkeitsvolumen, dann ruht dieses im Gleichgewicht in der gesamten Flüssigkeit. Das Gewicht, das dieses Volumen an Flüssigkeit hat, wird von den umgebenden Flüssigkeitsoberflächen kompensiert. Wäre das nicht so, würde dieses Flüssigkeitsvolumen hinabsinken.
Nun geht man einen Schritt weiter, und nimmt gedanklich dieses kleine Flüssigkeitsvolumen weg und ersetzt es durch einen anderen Körper. Die Drücke der verbleibenden Flüssigkeit auf dieses ausgetauschte Volumen werden in Summe wieder die gleiche Auftriebskraft liefern, wie vorher. Jetzt kommt es darauf an, welches Gewicht das ausgetauschte Volumen hat.
Wenn der Körper ein größeres Gewicht hat, wird er untergehen. Wenn er ein geringeres Gewicht hat, wird er aufsteigen. Wenn er dagegen das gleiche Gewicht hat, also das gleiche Volumen und die gleiche Dichte, dann schwebt er dort. Deswegen legen die Taucher auch Bleigewichte an, um möglichst schwebend durch das Wasser zu gleiten.
Das heißt also, dass die Auftriebskraft, die auf einen Körper in einem Fluid wirkt, nichts anderes ist als das Gewicht der verdrängten Fluidmenge.
Auftrieb =
Wobei Gewicht sehr wohl von Masse zu unterscheiden ist. Gewicht ist eine Kraft. Die Kraft, mit der eine Masse im Gravitationsfeld der Erde zu Boden gezogen wird. Bei der Auftriebskraft liefern die Eisberge ein schönes Anschauungsobjekt. Wasser hat ja die Eigenschaft, dass seine Dichte geringer wird wenn es friert. Insofern sinkt das Eis nicht hinab.
Eine weitere Eigenschaft von Fluiden, und insbesondere von Flüssigkeiten ist die Oberflächenspannung.
Was kann man sich unter einer „Oberflächenspannung” vorstellen?
Es gibt sogenannte „Kohäsionskräfte” zwischen den Molekülen. So ein Molekül hat zu allen seinen benachbarten Molekülen anziehende Wechselwirkungskräfte, die sich dann im Gleichgewicht alle zu Null kompensieren. Daher verharrt das Molekül an der Stelle, wo es sich gerade befindet. Man spricht auch von der „Kohäsion”, welche die Flüssigkeit zusammenhält.
Ein Molekül an der Flüssigkeitsoberfläche hat dagegen nur in eine Richtung Wechselwirkungskräfte. In diesem Fall gibt es eine resultierende Kraft, die nach innen zeigt. Das ist eine Kraft, die sich aufgrund der Kohäsion zwischen den Flüssigkeitsmolekülen ergibt. Das sind letztlich elektromagnetische Kräfte, die dazu führen, dass es Wechselwirkungen zwischen den Molekülen gibt.
Was passiert aber, wenn sich diese Flüssigkeitsoberfläche vergrößert. Bei einer größeren Oberfläche müssen ein paar Moleküle aus dem Innenbereich heraustreten, um an die Oberfläche zu gelangen. Und um das zu ermöglichen, muss eine Arbeit verrichtet werden. Und zwar eine Arbeit gegen die nach innen gerichtete Kohäsionskraft. Diese Arbeit ist charakteristisch für die jeweilige Flüssigkeit. Wenn man also ein Gefäß um eine gewisse Fläche ΔA und damit die Oberfläche erweitert, muss ein gewisser Arbeitsaufwand ΔW verrichtet werden.
Je Größer die Fläche ΔA ist, desto mehr Moleküle müssen an die Oberfläche treten. Und desto größer wird die verrichte Arbeit ΔW. Wie man sieht, verhält sich der Zusammenhang proportional. Und der Proportionalitätsfaktor ist die Oberflächenspannung σ:
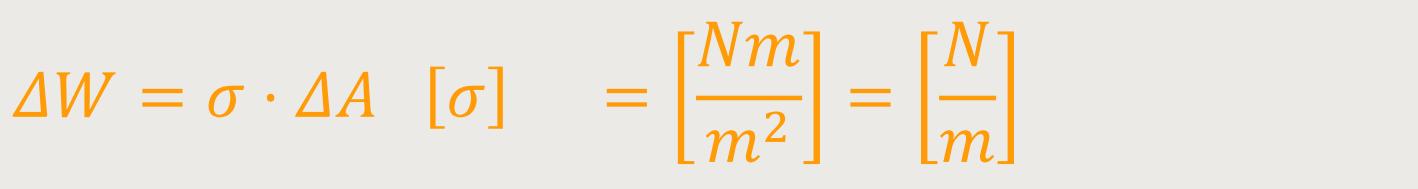
Die Oberflächenspannung ist üblicherweise nicht sehr groß,
sondern man bewegt sich da in Größenordnungen von
Die Einheit
Im Nachfolgenden betrachten wir dazu eine Art Seifenblase, also eine dünne Flüssigkeitsschicht.
Eine Flüssigkeitslamelle möchte aufgrund der inneren Spannung so klein wie möglich bleiben. Denn je kleiner sie ist bzw. je kleiner ihrer Oberfläche wird, desto weniger Oberflächenmoleküle müssen vorhanden sein. Obwohl diese Lamelle sehr dünn ist, hat sie eine Oberseite und eine Unterseite. Im Verhältnis zum Volumen entspricht das einer sehr großen Oberfläche.
Wird nun eine solche Lamelle an einem Rahmen aufgespannt und eine in der Ebene quer
laufende Strebe einseitig gezogen, kann die Oberfläche nicht anders, als sich
auszuweiten. Das bedeutet zwangsläufig, dass die Oberfläche
größer wird und mehr Moleküle aus dem Innern heraustreten müssen. Es
wird somit Arbeit geleistet. Die Person, die an der Querstrebe zieht, verrichtet diese
Arbeit. Die verrichtete Arbeit ist dann

F ist die aufgewendete Kraft
Δs ist der Weg, den die Stange überstreicht
Bei der Kraft handelt es sich um diejenige Kraft, die man gerade braucht um die Spannung, die diese Lamelle aufbaut, zu kompensieren.
Andererseits kann man auch die Vergrößerung der Oberfläche betrachten, die dabei entsteht. Die Oberfläche der Lamelle wird mit ΔA bezeichnet. Da es bei der Lamelle eine Oberseite und eine Unterseite gibt, bedeutet das:
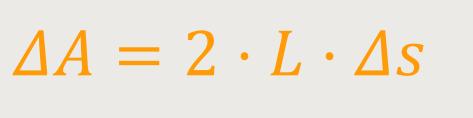
L ist die Breite des aufgespannten Rahmens
Jetzt lässt die Arbeit ΔW aufgrund der Definition der Oberflächenspannung alternativ ausrechnen:

Man greift mit der Querstrebe längs einer Grenzlinie dieser
Flüssigkeitsoberfläche an. Daraus ergeben sich eine vordere und eine hintere
Grenzlinie. Also, die gesamte Länge, an der hier angegriffen wird, ist genau
genommen
Wenn man nun beide Formalismen miteinander vergleicht, dann ist das letzten Endes dieselbe Arbeit. Dementsprechend kann man sofort die benötigte Kraft ausrechnen:
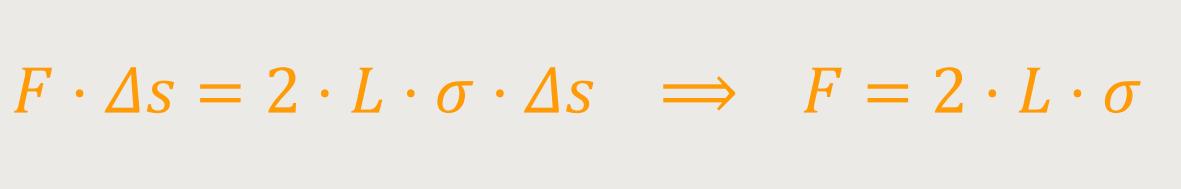
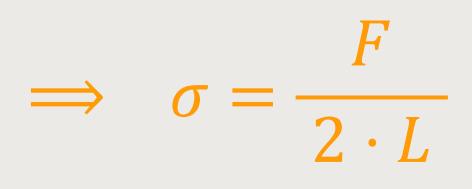
Daraus ergibt sich, dass die Oberflächenspannung konkret als Kraft pro
Länge der Grenzlinie einer Oberfläche aufgefasst werden kann. Und das
entspricht dann diesem
Jetzt kann man diese Oberflächenspannung auch dazu verwenden, um zu erklären, warum Flüssigkeiten in engen Röhren und engen Kanälen aufsteigen. Das ist eine der ganz wichtigen Eigenschaften der Oberflächenspannung.
Unter dem Begriff „Kapillare” versteht man eine enge Röhre, die nur ein paar zehntel Millimeter Durchmesser hat. In solch dünnen Röhren neigen Flüssigkeiten dazu, aufzusteigen. Man sagt auch, die Flüssigkeit steigt aufgrund der „Kapillarität” auf. Und diese Kapillarität hat mit der Oberflächenspannung einer Flüssigkeit zu tun.
Denken wir uns wieder ein Gefäß, in das ein dünnes Glasröhrchen bis knapp unter die Wasseroberfläche eintaucht. Also, ein Röhrchen mit einer engen Kapillare. Was wir jetzt gedanklich durchspielen wollen, führt in das recht komplizierte Gebiet der Oberflächenphysik. Man geht davon aus, dass die betrachteten Oberflächen von der jeweiligen Flüssigkeit „benetzt” werden. Das heißt, wenn man die Oberfläche eintaucht, und wieder rausholt, bleibt ein dünner Flüssigkeitsfilm an der Oberfläche haften, selbst wenn es nur monomolekular ist. Die Flüssigkeitsmoleküle bleiben aufgrund von Oberflächenkräften, auch Van der Waals Wechselwirkungskräfte genannt, haften. Diese Wechselwirkungskräfte sind letztlich wieder elektrodynamische Kräfte.
Es gibt aber auch nicht benetzbare Systeme. Bei Teflon zum Beispiel perlt das Wasser ab. Alles in allem gibt es benetzbare und nicht benetzbare sowie mehr oder weniger benetzbare Oberflächen. Wie benetzbar eine Oberfläche ist, wird durch das Phänomen des Kontaktwinkels beschrieben. Der Kontaktwinkel Null bedeutet, dass sich ein Flüssigkeitstropfen ganz flach ausbreitet, wenn man ihn auf eine Oberfläche aufträgt. Dagegen spricht man von einem größeren Kontaktwinkel, wenn sich die Flüssigkeit zu einem Tropfen ausbildet. Quecksilber bildet sich sogar zu einem kugelförmigen Tropfen aus, der sich nicht benetzen will.
Letztlich sind das Fragen der Energiezustände. Man spricht dann von
„Grenzflächenenergie” zwischen der Flüssigkeit und dem
darunterliegenden Substrat. Es handelt sich quasi um substanzabhängige
Eigenschaften. Aber selbst wenn man nur Wasser hernimmt, und es auf dem Blatt einer
Lotuspflanze betrachtet, ist der Kontaktwinkel
Bei unserer Betrachtung setzen wir eine vollständige Benetzbarkeit voraus. In diesem Fall ist es so, dass die Kapillare durch Eintauchen schon einmal mit der Flüssigkeit benetzt wurde. Die Innenfläche dieser Kapillare trägt bereits eine dünne, vielleicht nur monomolekulare Schicht der Flüssigkeit. Die Flüssigkeit will aber seine Oberfläche so klein wie möglich halten, damit nicht zu viele Oberflächenmoleküle vorhanden sind.
Die Moleküle streben somit nach innen, wo ihr Energiezustand geringer ist. Und das bedeutet wiederum, dass sich in der Kapillare am Rand eine seitliche Erhöhung des Wasser- oder Flüssigkeitsspiegels ergibt. Dadurch wird die verbleibende Oberfläche oberhalb des Flüssigkeitsspiegels geringer. Je weiter das Wasser nach oben steigt, desto günstiger wird es dann. Aber warum steigt es oftmals nicht endlos nach oben?
In diesem Fall bedarf es einer Arbeit gegen die Schwerkraft, um so hoch aufsteigen zu können. Und es steigt gerade so hoch, dass es ein optimales Verhältnis gibt. Dann spricht man von der Steighöhe h, um die eine Flüssigkeit aufsteigt. Und diese Steighöhe lässt sich ebenfalls mithilfe der Oberflächenspannung ausrechnen:
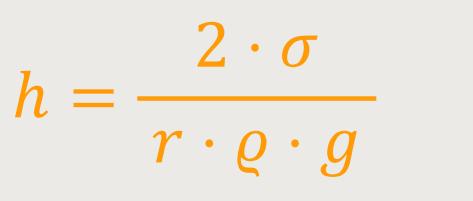
σ ist die Oberflächenspannung
g ist die Fallbeschleunigung
ϱ ist die Dichte der Flüssigkeit
r ist der Radius der Kapillare
Je dichter die Flüssigkeit ist, desto mehr Hubarbeit muss verrichtet werden. Der Radius steht im Nenner, und je dünner die Kapillare im Innern wird, desto höher steigt die Flüssigkeit.
Also, für vollständige Benetzbarkeit gibt es obigen einfachen Zusammenhang. Und so lässt sich mittels der Steighöhe bei bekanntem Kapillarradius die Oberflächenspannung ermitteln. Flüssigkeiten mit einer höheren Oberflächenspannung σ steigen dementsprechend auch höher auf. Und was noch wichtiger ist, dieses Phänomen ist dafür verantwortlich, dass in den Bäumen, wo es viele kleine Kapillare gibt, die Flüssigkeit vom Boden aufsteigt.
⇦ Kapitel Kapitel ⇨
