Der „Schweredruck” bei Gasen ist nicht ohne Bedeutung, denn wir alle bewegen uns in einem Gas. Ohne dieses Gasgemisch könnten wir nicht existieren. Die Reichweite dieses Gases geht bis in höhere Sphären hinauf. Und wenn man sich in diese höheren Regionen begibt, wird der Druck immer geringer und das Gas immer dünner. Irgendwann kann man ohne Hilfsmittel nicht mehr atmen.
Nachfolgend betrachten wir das Verhalten von Gasen unter dem Einfluss der Schwerkraft.
Wie viel Masse steckt wohl unter Normalbedingungen in so einem m³
Luft? Wasser hat, wie wir gesehen haben, eine ziemlich große Masse pro Volumeneinheit.
Beim Gas liegt die Masse bzw. der Druck bei 1 bar, das entspricht
etwa
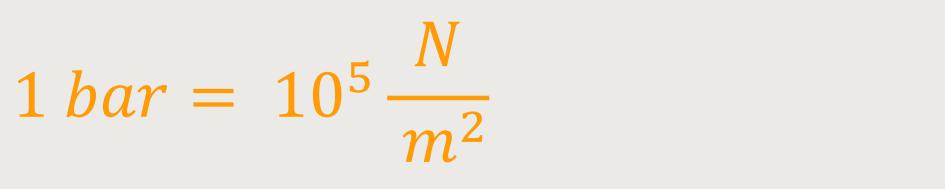
Jetzt wollen wir untersuchen, wie sich so etwas ausrechnen lässt. Und da verhält es sich ganz analog, wie es bei den Flüssigkeiten der Fall war. Der Unterschied ist nur, dass wie bereits erwähnt die Dichte nicht konstant ist. Flüssigkeiten verzeichnen unter Druck keine nennenswerte Veränderung der Dichte. Das liegt an der sehr geringen Kompressibilität von Flüssigkeiten. Gase hingegen, wozu auch die uns umgebende Luft gehört, lassen sich sehr wohl komprimieren.
Um das ausrechnen zu können, müssen wir ein bisschen auf die Thermodynamik vorgreifen. In der Thermodynamik gibt die sogenannte „Zustandsgleichungen” idealer Gase. Und die Luft ist in guter Näherung ein ideales Gas. Der Aspekt, der zunächst für uns wichtig ist, hat mit einer konstanten Temperatur zu tun. Gesetzt den Fall, in dem System herrscht eine konstante Temperatur, gibt es das Boyle-Mariottesche Gesetz. Das ist ein sehr wichtiges Gesetz und lautet:

Mit anderen Worten, wenn man den Druck verdoppelt, wird das Volumen halb so groß. Im Allgemeinen kann man davon ausgehen, dass in jedem Teilsystem, welches man untersucht, die Masse gleich bleibt m = const. Das bedeutet:


ϱ ist
Also, wenn das Volumen halb so groß ist, wird die Dichte doppelt so groß. Damit
ist

Somit lässt sich schlussfolgern, dass es an einer bestimmten Stelle, zum Beispiel am Erdboden, einen gewissen Referenzdruck und eine gewisse Referenzdichte gibt. Mittels dieser Referenzwerte lassen sich der Druck und die Dichte ermitteln. Damit erhält man:
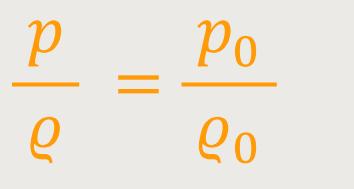
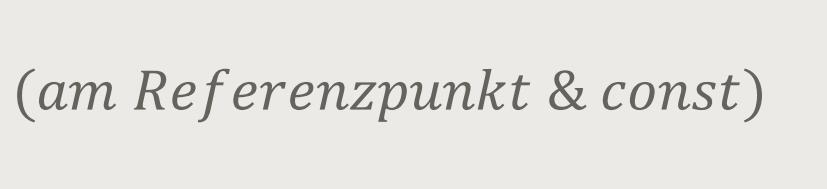
Und letztlich lässt sich die Dichte ausrechnen:
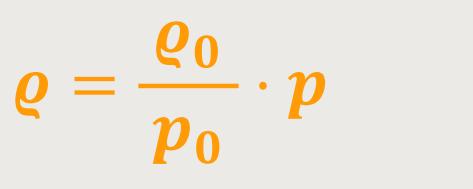
Mit dieser einfachen Beziehung wird die Dichte als Funktion des Druckes definiert. Vorausgesetzt wir haben es mit einer konstanten Temperatur zu tun. Um das im Einzelnen berechnen zu können, benötigt man analog wie beim Wasser in diesem Fall eine Gas-Säule. Man betrachtet zwar die gesamte Atmosphäre, greift aber gedanklich nur ein säulenförmiges Stück heraus. Anschließend wird untersucht, welcher Zusammenhang besteht.
h ist die Höhe dieser Gas-Säule
A ist die Querschnittsfläche
Diesmal fängt man vom Bodenniveau an. Man untersucht in einer solchen Säule
wieder einen bestimmten Höhenabschnitt h. Am Boden befindet
sich die Höhe Null. Der Höhenabschnitt wird definiert von
h bis
Das Volumen ergibt sich ähnlich wie bei Flüssigkeiten:
Und damit ist die Geometrie für die Gas-Säule festgelegt. Wie wird sich der Druck ändern, und wodurch ändert er sich? Nun, zunächst einmal hat dieser Abschnitt innerhalb der Gas-Säule auch wieder eine gewisse Masse und damit auch ein gewisses Gewicht. Aufgrund des zusätzlichen Gewichts dieses Höhenabschnitts, wird auch hier der Druck an der unteren Querschnittsfläche zunehmen.
Das Gewicht dieses Volumenelements ist definiert als:
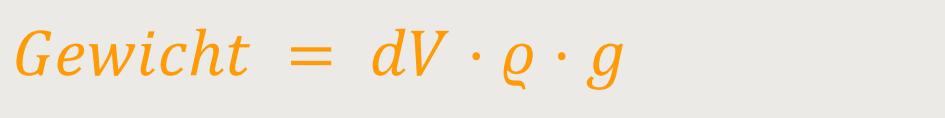
dV ist das Volumen dieses Volumenelements des Gases
ϱ ist die Dichte dieses Gases
g ist die Fallbeschleunigung
Masse = Dichte · Volumen
Gewicht = Masse · Fallbeschleunigung
Dieses Gewicht bewirkt jetzt die Druckänderung. Denn das Gewicht lastet zusätzlich auf der unteren Querschnittsfläche. Für die Druckänderung ergibt sich demnach:
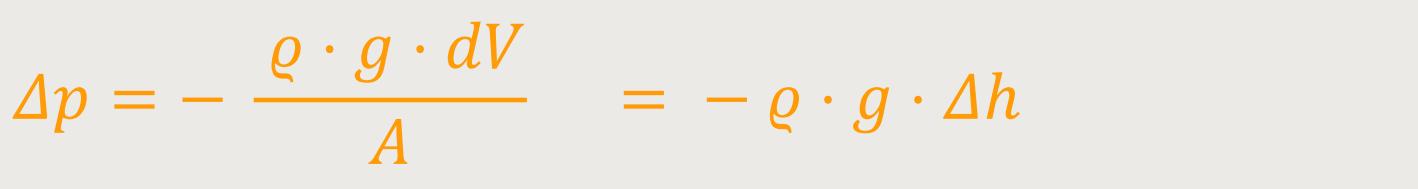
Δh ist die Höhenänderung des Gases
Der Zusammenhang mit der Druckabhängigkeit stellt sich wie folgt dar:
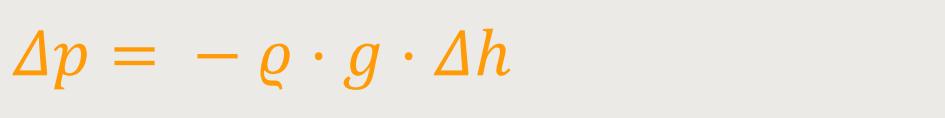
Anders als bei Flüssigkeiten ist die Dichte hierbei nicht konstant. Denn die Dichte eines Gases ist abhängig vom Druck.
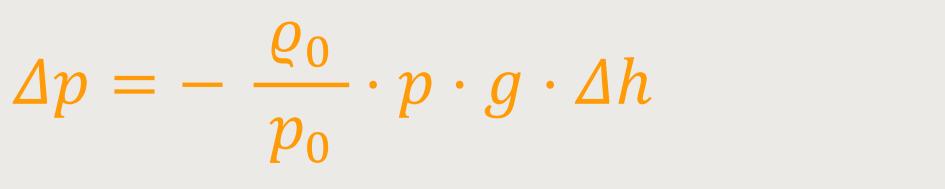
Man kann schon erkennen, dass man hier eine Differenzialgleichung erhält. Da der Druck variabel ist, müssen wir deshalb anders vorgehen. Zunächst führt man eine Trennung der Variablen durch. Weshalb ist das wichtig?
Weil es sowohl eine abhängige als auch eine unabhängige Variable gibt. Unabhängig ist die Höhe h. Abhängig ist aber der Druck p. Man möchte ja wissen, wie h mit p zusammenhängen. Trennung heißt, der Druck p muss in der Gleichung auf die andere Seite:
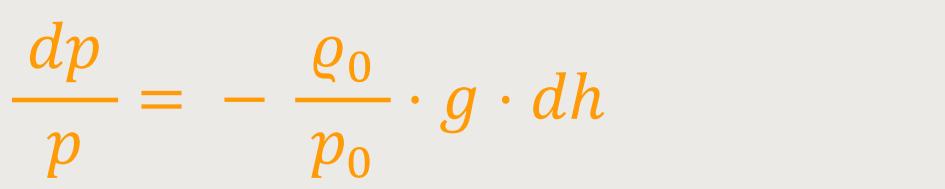
− (ϱ₀ / p₀) · g ist wieder eine Konstante
Zur Berechnung des Drucks muss man jetzt nur noch integrieren. Hierzu nimmt man ein Integral des Ausgangsdruckes der Oberfläche. Das kann zum Beispiel der Atmosphärendruck am Erdboden sein, bis zu dem geringeren Druck in der entsprechenden Höhe:
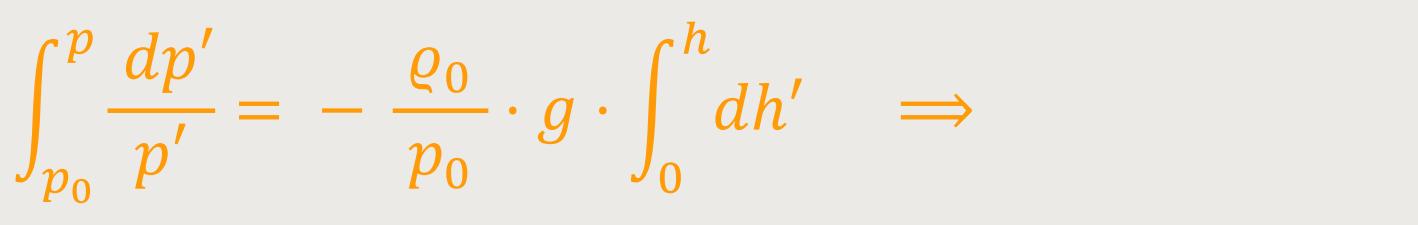
Das Integral
Somit kommt ein logarithmus naturalis mit in die Gleichung herein:
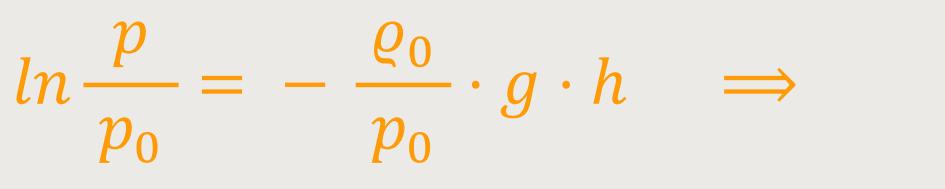
Anschließend wird eine Exponenzierung

Nach Umformen erhält man:
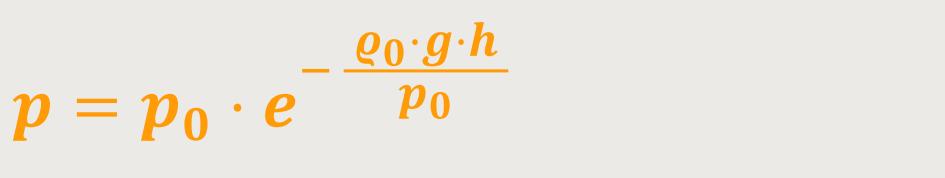
Und das ist die berühmte Barometrische Höhenformel.
Mit dem Barometer misst man bekanntlich den Luftdruck. Aber wie muss man sich das konkret vorstellen? Aus dieser Formel ergibt sich, dass zwischen der Höhe und dem Druck kein linearer Zusammenhang besteht. Insofern ist es hilfreich, insbesondere für die Atmosphäre entsprechende Zahlenwerte mit anzugeben.
Damit das Ganze etwas greifbarer wird, hier einige Werte aus unserer Atmosphäre:
Einen Druckabfall auf p₀ /2 erreicht man in 5,8 km Höhe. Wenn man aber einen Druckabfall auf p₀ /4 erreichen möchte, muss man schon auf 11,5 km aufsteigen. Bei Flüssigkeiten hört der Druck an der Oberfläche einfach auf.
Bei der Atmosphäre ist das nicht so, sie wird nach oben hin immer dünner. Es gibt einen kontinuierlichen Übergang, solange bis sich kein Druck mehr messen lässt. In diese Höhen kann man sich nur noch formalistisch fragen: In welcher Höhe geht der Druck um wie viel zurück? Die Gase haben unter Einwirkung der Schwerkraft keine definierte obere Grenze.
Ein weiterer wichtiger Punkt, den wir betrachten wollen, ist das Phänomen des Auftriebs.
⇦ Kapitel Kapitel ⇨
