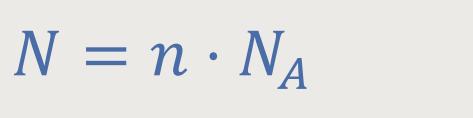Um das Thema Wärmekapazität anschaulich zu machen, stellt man sich gedanklich einen Paraffinblock vor, und dazu zwei Metallzylinder mit gleichen Abmessungen. Der eine Metallzylinder besteht aus Blei, der andere aus Stahl, wobei der Bleiklotz natürlich schwerer ist. Beide Zylinder werden in kochendem Wasser auf 100°C erhitzt. Anschließend werden beide auf den Paraffinblock gestellt.
Jetzt geht es darum zu ermitteln, wie groß die in dem jeweiligen Metallzylinder gespeicherte Wärmeenergie ist. Wenn der eine Zylinder eine deutliche höhere Wärmeenergie hat als der andere, wird er auch tiefer in das Paraffin einsinken. Zunächst würde man erwarten, dass das Blei aufgrund seines Gewichtes tiefer einsinken wird. Aber Experimente zeigen, dass vielmehr der Stahlzylinder tiefer einsinkt.
Generell gilt daher, dass die Aufnahmefähigkeit von Körpern, was ihre Wärmemengen angeht, bei verschiedenen Materialen unterschiedlich groß ist. Dass ein solcher Unterschied besteht, kann mit Hilfe der Wärmekapazität beschrieben werden. Wir hatten diese schon einmal definiert:

Γ (Gamma) ist die allgemeine Wärmekapazität des betrachteten Körpers
Die Wärmekapazität ist ein konstanter Faktor. Demnach ist die Wärme, die man in einen Körper hineinsteckt, proportional zur Änderung der Temperatur. Gibt man doppelt sowie Wärme in den Körper hinein, dann wird auch die Temperaturerhöhung doppelt so groß sein. Und das führt dazu, dass man sich entweder auf die Masseneinheit (kg) oder auf die Einheit mol bezieht. Und so lässt sich einerseits eine spezifische Wärmekapazität definieren:
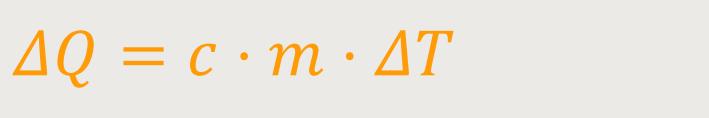
Das ist die Wärmekapazität pro Masseneinheit.
c ist die spezifische Wärmekapazität
m ist die Masse des Systems
Multipliziert mit der Masse des Systems erhält man die spezifische Wärmekapazität, auch „spezifische Wärme” genannt. Je größer die Masse ist, desto mehr Wärme muss zugeführt werden, um die Temperatur um ein ΔT zu erhöhen. Und die Wärmekapazität belegt entsprechend, dass dies bei verschiedenen Materialien unterschiedlich ist.
Alternativ dazu definiert man die Molare Wärmekapazität:
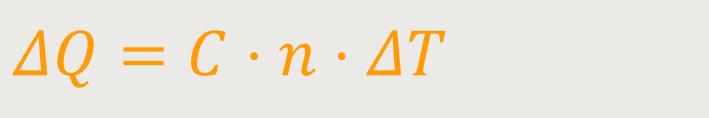
C ist die Molare Wärmekapazität
(auch Mol-Wärme genannt)
n ist die Molzahl des betrachteten Systems
Nachdem wir uns das nochmals kurz in Erinnerung gerufen haben, können gehen wir einen Schritt weiter. Wie bereits erwähnt, lässt sich die Temperatur interpretieren, als ein Maß für die mittlere kinetische Energie pro Freiheitsgrad des Moleküls. Wenn man weiß, wie viel kinetische Energie in einem Molekül enthalten ist, können weitere Berechnungen durchgeführt werden. Wir gehen wieder von idealen Gasen aus, sprich es gibt keine Wechselwirkungen zwischen den Teilchen. So gelangt man schließlich auf die innere Energie eines idealen Gases, die wie folgt definiert ist:
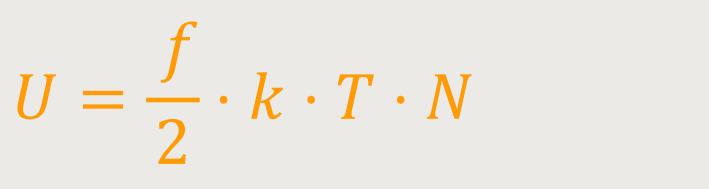
f ist die Anzahl der Freiheitsgrade
N ist die Gesamtanzahl der betrachteten Moleküle
Die innere Energie ist gleich der kinetischen Energie für
Und jetzt kann man noch eine einfache Umformung machen. Hierzu erinnern wir uns:
Dementsprechend erhält man:
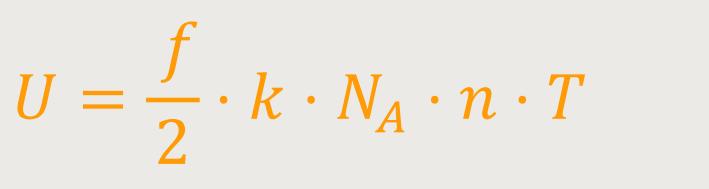
Und dieses k · NA ist die allgemeine Gaskonstante R, die wir bereits von der Zustandsgleichung her kennen. Und damit ergibt sich:
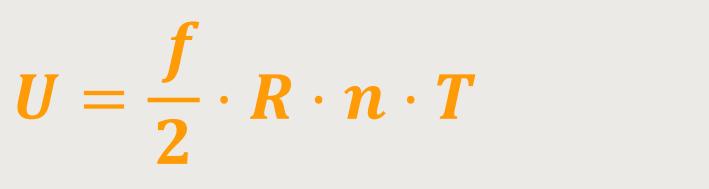
Das ist die gesamte innere Energie eines idealen Gases.
Mit diesem Ausdruck kann man unmittelbar ausrechnen, wie viel Wärme man zuführen muss, um eine Temperaturänderung zu bewirken.
Die absolute Temperatur T ist ein Maß für die mittlere kinetische Energie eines Moleküls in dem entsprechenden Körper. Die Temperatur zeigt an, wie hektisch die Moleküle in einem Körper unterwegs sind. Wenn man diese kinetische Energie eines Moleküls in einem Körper kennt, dann ist es ein geringer Aufwand, die gesamte innere Energie der ungeordneten Molekülbewegungen in dem Körper zu ermitteln.
Immer vorausgesetzt, man hat gleichartige Moleküle. Denn wir gehen zunächst immer nur von homogenen einfachen Systemen aus. Wenn man eine Mischung von mehreren verschiedenen Substanzen hat, muss das entsprechend aufsummiert werden. Doch in unserem Fall gehen wir von einer Substanz mit nur einer Art Molekülen aus.
Wenn man weiß wie groß die mittlere kinetische Energie der ungeordneten
Molekülbewegung für
Was passiert, wenn man eine Zustandsänderung bei einem solchen idealen Gas
durchführt? Das kann zum Beispiel in Form einer Wärmezufuhr geschehen, wobei
das Volumen dieses Gases

Wenn man voraussetzt, dass sich das Volumen nicht ändert, wird von diesem System auch keine mechanische Arbeit geleistet. Denn nur wenn sich ein Volumen ändert, kommt es zu einer Arbeitsleistung. Daher verbleibt die Wärme vollständig in Form der inneren Energie in dem System. Und die Änderung der inneren Energie ΔU kann man sofort aufschreiben als:
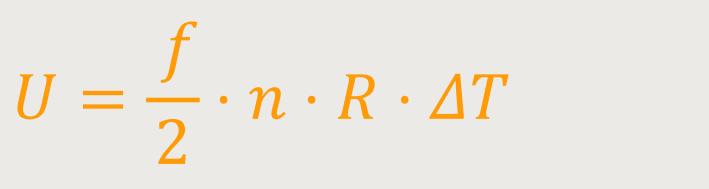
Weiter oben haben wir bereits die spezifische und die molare Wärmekapazität betrachtet.
Die Molare Wärmekapazität, oder auch „Mol-Wärme” genannt, war bereits (s.o.) definiert als :
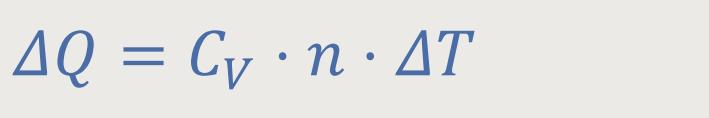
Jetzt schreibt man
Wenn man beide Beziehungen gleichsetzt und anschließend umformt, ergibt sich entsprechend:
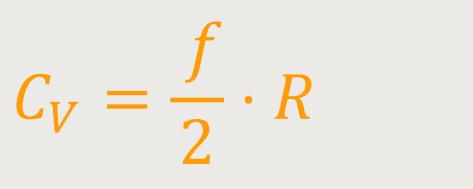
Sowohl die molare Wärmekapazität als auch die Gaskonstante kann gemessen werden. Auf diese Weise lassen sich auch die Anzahl der Freiheitsgrade ermitteln. Und so erhält man aus einfachen makroskopischen thermodynamischen Messwerten letztlich mikroskopische Informationen. Denn die Anzahl der Freiheitsgrade gibt Informationen darüber, wie viel Translationsfreiheitsgrade ein Molekül hat bzw. ob es rotieren kann oder ob es schwingen kann.
Mit dieser relativ einfachen Beschreibung der Thermodynamik erhält man sogar einen direkten Zugang zu Quanteneffekten. Denn aufgrund der Abnahme der Temperatur werden zunehmend mehr und mehr Freiheitsgrade eingefroren. Sprich, es muss eine gewisse Mindestenergie vorhanden sein, um bestimmte Freiheitsgrade überhaupt anzuregen. Und wenn die Temperatur kleiner wird, ist auch die thermische Energie kleiner. Oder anders ausgedrückt, es können zunehmend weniger von den vorhandenen Freiheitsgraden angeregt werden, weil deren untere Energieschwelle zu hoch ist. Erst durch die Quantenphysik hat man eine konkrete Möglichkeit erhalten, das zu interpretieren.
Alternativ dazu kann man auch die Wärmezufuhr für den Fall betrachten, dass der Druck p = const bleibt. Dazu stellt man sich gedanklich wieder ein Gasvolumen in einem Zylinder vor, in welchem sich ein Kolben bewegen kann. Wenn man jetzt Wärme zuführt, dehnt sich das Gas entsprechend aus, und der Kolben leistet Arbeit. Obwohl der Druck konstant bleibt, passieren also zwei Dinge. Erstens wird bei der Wärmezufuhr ΔQ die innere Energie zunehmen. Man kann auch von einer Zufuhr von Energie ungeordneter Molekülbewegungen sprechen. Zweitens bewegt sich der Kolben, was bedeutet, er verrichtet Arbeit −ΔW.
Hierbei gilt, dass Größendifferenzen, die dem System zugeführt werden, einen positiven Wert haben. Wogegen alles, was vom System abgeführt wird, einen negativen Wert hat. Insofern wird die Arbeit von dem System in die Umgebung abgegeben, damit beispielsweise ein Motor das Auto antreibt.
Wenn man also eine Wärmemenge zuführt, und gleichzeitig Arbeit verrichtet, erhält man:

In diesem Fall geht die Wärmemenge nur teilweise in die innere Energie ΔU des Systems über. Denn ein anderer Teil wird in mechanische Arbeit abgeführt. In dieser Beziehung ist bereits der Energieerhaltungssatz enthalten. Das, was man an Energie der ungeordneten Molekularbewegung hineinsteckt, geht zum Teil in die Änderung der inneren Energie und zum Teil in Abführung von mechanischer Arbeit in die Umgebung.
Eigentlich haben wir mit obiger Gleichung schon den ersten Hauptsatz der Wärmelehre. Dieser Hauptsatz sagt im Grunde nichts anderes aus, als das der Energieerhaltungssatz auch bei thermodynamischen Systemen Anwendung findet. Aber dazu kommen wir noch konkret. Also, die Änderung der inneren Energie hängt mit einer Änderung der Wärme und mit dem Verrichten von mechanischer Arbeit zusammen. Nur so kann sich die innere Energie ändern.
Was bedeutet das konkret für obigen Fall?
Der Temperaturzuwachs ΔT wird jetzt bei konstantem Druck kleiner sein, als bei konstantem Volumen. Denn ein Teil bleibt noch übrig für die Arbeitsverrichtung.
Die verrichtete Arbeit lässt sich daher ausrechnen als:

F Kraft auf die Kolbenfläche
Δs ist die Wegstrecke des Kolbens
A ist die Kolbenfläche
Andererseits gilt folgendes:
F / A entspricht dem Druck p auf die Kolbenfläche
A · Δs ist die Änderung des Volumens ΔV
Somit lässt sich die verrichte Arbeit auch wie folgt ausdrücken:
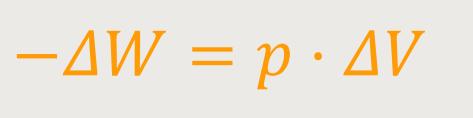
Für die Wärmemenge kann man jetzt, bezogen auf die innere Energie und unter Berücksichtigung der abgeführten Arbeit, schreiben:

Gleich folgt noch eine kleine Umformung, und schon ist man fast am Ziel. Zunächst erinnern uns, für ein ideales Gas gilt ja:
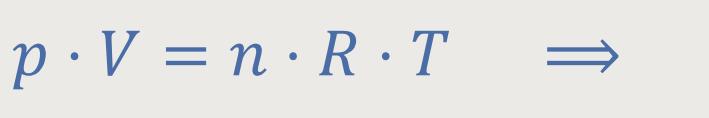
Da der Druck in diesem Fall ein konstanter Faktor ist, wird sich nur das Volumen ändern und entsprechend auch die Temperatur:
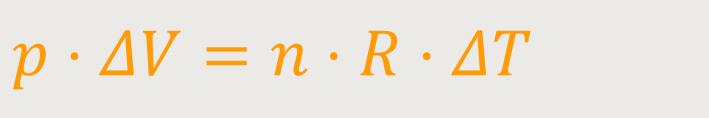
Der Kolben bewegt sich in einem Umfeld, bei dem der Außendruck und auch der Innendruck immer in einem Gleichgewicht bleiben. Wird dieser Ausdruck entsprechend eingesetzt, erhält man schließlich:
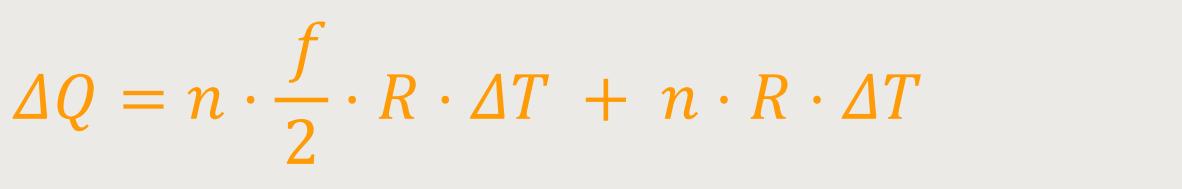
Nach einer weiteren Umformung ergibt sich:
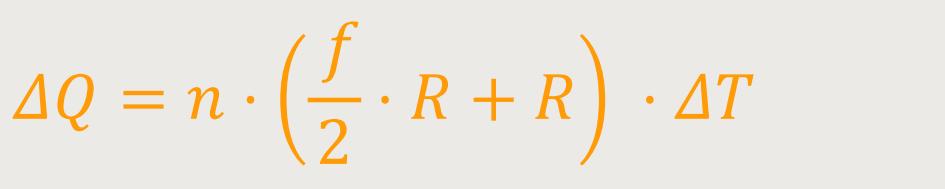
Wenn man das jetzt weiter oben mit der Definition bei konstantem Volumen vergleicht, ergibt
sich eine gewisse Ähnlichkeit. Da CV die Molwärme
bei konstantem Volumen ist, wird jetzt daraus die Molwärme
Cp bei konstantem Druck. In der Gleichung entspricht also
das Cp dem
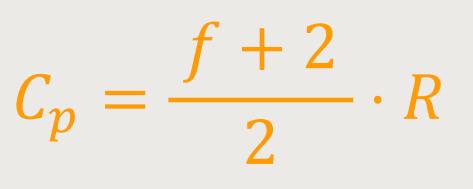
Dieses System hat deshalb eine größere Wärmekapazität, weil man mehr Wärme zuführen muss, um eine bestimmte Temperaturänderung zu erreichen. Und warum ist das so? Weil ein Teil der Wärme in mechanische Arbeit umgesetzt wird.
Wesentlich ist also, dass bei gleicher zugeführter Wärme die Temperatur hier weniger stark ansteigt. Und das bedeutet, dass die Wärmekapazität dieses Systems bei konstantem Druck größer ist. Das System kann demnach mehr Wärme aufnehmen, bis eine bestimmte Temperaturerhöhung erreicht ist. Außerdem kann sich das System ein bisschen ausdehnen.
Und wenn man das jetzt nochmals umformt, erhält man für die Gaskonstante, unter Berücksichtigung eines idealen Gases:
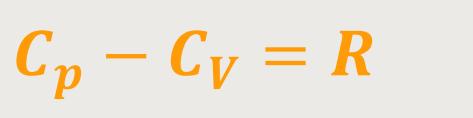
Und letztlich lassen sich beide Größen auch ins Verhältnis setzten:
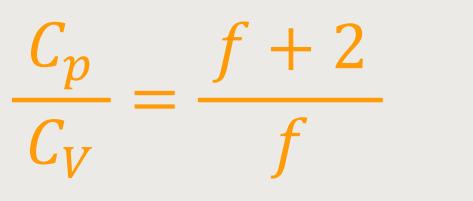
Dadurch erhält man eine Möglichkeit, die Anzahl der Freiheitsgrade
experimentell bestimmen zu können. Dieses Verhältnis wird oft auch als
Die Flüssigkeiten werden hier wegen ihrer Komplexität nicht näher beleuchtet. Was man dagegen besser beschreiben kann, ist das Verhalten von Festkörpern. Aber auch dieser Bereich ist sehr komplex. Dennoch werden wir einen wichtigen Fall herausgreifen.
Für Festkörper gibt es einen wesentlichen Unterschied. In Festkörpern sausen die Moleküle nicht so wild herum, sondern im Wesentlichen zittern sie rund um eine Position. Denn wenn sie sich stark herumbewegen würden, hätten wir ja eine Flüssigkeit, und keinen Festkörper.
Hierzu kann man sich eine
Bleibt man dagegen innerhalb gewisser Grenzen, weit weg vom Schmelzpunkt, haben diese kleinen Oszillatoren eine kinetische Energie, wenn sie schwingen. Sie haben aber auch eine potentielle Energie, wenn sie sich aus ihren Gleichgewichtslagen herausbewegen. Also zu den Translationsenergien, aufgrund der kinetischen Energie dieser Gitteratome, kommt in gleichem Maße noch eine mittlere potentielle Energie hinzu, wenn die Atome aus ihren Gleichgewichtslagen wegschwingen.
Das heißt, man hat jetzt nicht nur drei Freiheitsgrade, die mit der Energie gekoppelt sind, sondern drei weitere, bei der die potentielle Energie mit eingeht. Das trifft zum Beispiel auf die Gasmoleküle nicht zu, denn dort kommt es nur dann zu einer Wechselwirkung, wenn sie zufällig gerade zusammenstoßen. Und deshalb bedeutet das für die Festkörper, dass sich die Mol-Wärme C entsprechend ändert.
Das f besteht jetzt aus

Das ist das Dulong-Petitsche Gesetz, welches bei vielen Festkörpern erfüllt ist.
Bei der Thermodynamik kann man mit relativ einfachen Mitteln vieles über das Verhalten von Systemen aussagen, ohne im Einzelnen die Struktur und die Wechselwirkungen der Moleküle kennen zu müssen.
⇦ Kapitel Kapitel ⇨