Die Thermodynamik gehört zu den Hauptpfeilern der Physik. Nachfolgend wenden wir uns schwerpunktmäßig dem Energieaustausch in thermodynamischen Systemen zu. Denn gerade aufgrund thermodynamischer Gesetzmäßigkeiten ist es möglich, Maschinen zu konstruieren, die es ermöglichen Arbeit zu leisten.
Um aber Energieübergänge nachvollziehbar beschreiben zu können ist es sinnvoll, sogenannte „Hauptsätze in der Thermodynamik” einzuführen. Dabei handelt es sich um grundlegende Sätze, die teilweise auf den allgemeinen und uns bereits bekannten Gesetzmäßigkeiten beruhen. Diese Hauptsätze basieren insbesondere auf der Energieerhaltung. Es kommen teilweise auch neue Aspekte hinzu, die in der Physik kleiner Systeme noch nicht vorhanden waren.
Einerseits handelt es sich bei der Thermodynamik um ein in sich geschlossenes Themengebiet. Andererseits hat es auch gewisse Schwierigkeiten in sich, weil man mit Größen konfrontiert wird, die man zwar eindeutig definieren kann und die sich auch ausrechnen lassen. Aber manches lässt keine unmittelbare anschauliche Interpretation zu, wie das bisher in der Physik der Fall war. Man muss sich damit abfinden, dass man im Bereich der Thermodynamik mit Größen operiert, die nicht immer nachvollziehbar sind. Wenn man noch keine konkrete Vorstellung von gewissen Abläufen hat, kann man nur versuchen, intuitiv einen Bezug herzuleiten.
Dennoch wollen wir die bisher gewonnenen Erfahrungen analysieren, die man im Zusammenhang mit thermodynamischen Systemen und insbesondere mit dem Energieaustausch in thermodynamischen Systemen gewonnen hat. Und da hat sich herauskristallisiert, dass man mit Hilfe von drei Hauptsätzen im Wesentlichen die Dinge, die für den Energieaustausch in thermodynamischen Systemen wichtig sind, beschreiben kann. Die wollen wir jetzt nachfolgend Schritt für Schritt behandeln.
Als Basis der Betrachtung werden wir zunächst einige Bezeichnungen erläutern. Hierbei werden wir es mit „Zustandsgrößen” zu tun haben. Eine Zustandsgröße ist eine makroskopische Beschreibungsgröße für ein System, wie zum Beispiel der Druck, die Temperatur oder das Volumen eines Systems. Dies sind Größen, die einem System zukommen, ohne dass man sagen muss, in welcher Weise und auf welchem Weg man zu diesem Zustand gelangt ist. Das trifft grundsätzlich auf alle Größen zu. So ist beispielsweise die Wärmemenge Q keine Zustandsgröße, denn man kann auf unterschiedliche Weise zu bestimmten Zuständen kommen. Wenn man einem System Wärme zuführt, kann einerseits die innere Energie U höher werden. Doch ein Teil dieser Wärmemenge kann auch in mechanische Arbeit umgesetzt werden.
Es besteht nämlich ein Unterschied, ob die Wärme komplett in innere Energie umgesetzt wird, ober ob ein Teil davon in mechanische Arbeit übergeführt wird. Insofern ist die Wärmemenge ein typisches Beispiel dafür, dass es auch Größen gibt, die keine Zustandsgrößen sind. Das ist ein gravierender Punkt. Denn ohne Verständnis dieses Punktes kann man auch nicht verstehen, wieso es thermodynamische Maschinen gibt, die mechanische Arbeit leisten können.
Sowohl die Wärmemenge als auch die verrichtete Arbeit sind keine Zustandsgrößen. Es handelt sich hierbei vielmehr um „Grenzflächenkonzepte”. Denn über die Grenzfläche eines Systems kann man eine gewisse Wärmemenge von außen nach innen transportieren. Und umgekehrt kann man eine gewisse Arbeit verrichten, die dieses System an die Umgebung abgibt. Immer dann, wenn etwas ineinander umgesetzt wird, handelt es sich nicht um eine Zustandsgröße.
Spricht man dagegen eindeutig von einer Zustandsgröße, sind diese Größen entweder proportional zur Systemmasse oder unabhängig von der Systemmasse. Das heißt, es sind entweder extensive Größen, wie zum Beispiel das Volumen V eines Systems oder die innere Energie U eines Systems. Während der Druck p und die Temperatur T intensive Größen sind.
Des Weiteren kann auch ein thermodynamisches Gleichgewicht vorliegen. Darunter versteht man eine Situation, bei der die Zustandsgrößen in einem System, die dieses System beschreiben, zeitlich invariant sind.
Dann gibt es noch die Zustandsgleichung. Darunter versteht man eine Funktion der
Größen
Eine letzte wesentliche Erläuterung betrifft die Änderung von Zuständen. Also, wenn man von einem Zustand in einen anderen Zustand überwechselt. Bei derartigen Vorgängen gibt es reversible und irreversible Zustandsänderungen. Man spricht von einer reversiblen Zustandsänderung, wenn die zeitliche Umkehr der äußeren Bedingungen, die zunächst zu der Zustandsänderung geführt haben, auch wieder zu einer Umkehr der Zustandsänderung führt. Das heißt, wenn man beispielsweise in einem Kolbenzylinder den Kolben ein Stück herauszieht, dann hat man dadurch eine Zustandsänderung hervorgerufen. Wenn man jetzt den Vorgang umkehrt, indem man den Kolben wieder zurückschiebt, bewirkt hat man somit die Umkehrung dieser Zustandsänderung. Bei einer derartigen Zustandsänderung spricht man von einem „reversiblen” Prozess.
Dagegen kann man ein System in einem Zylinder betrachten, in welchem sich zum Beispiel ein Ventil befindet. Die eine Hälfte des Zylinders wurde mit Gas befüllt, und in der anderen Hälfte wurde ein Vakuum erzeugt. Öffnet man jetzt das Ventil, fließt das Gas ins Vakuum. Wenn man nach kurzer Zeit das Ventil wieder schließt, liegen in beiden Bereichen die gleichen Druckverhältnisse vor. Würde man jetzt das Ventil wieder öffnen, wird das Gas nicht wieder zurückfließen. Eine Umkehr der äußeren Bedingungen, die zunächst zur Zustandsänderung geführt haben, macht die Zustandsänderung nicht wieder rückgängig. Dann spricht man von einem „irreversiblen” Prozess.
Aus zahlreichen experimentellen Erfahrungen lässt sich demzufolge der „Erste Hauptsatz” der Thermodynamik festlegen. Er gilt für beliebige Zustandsänderungen und besagt:
Die Summe der einem System zugeführten Wärme und der einem System zugeführten Arbeit ist gleich der Zunahme der inneren Energie dieses Systems.

ΔU ist die Änderung der inneren Energie
ΔQ ist die zugeführte Wärme
ΔW ist die zugeführte Arbeit
Die innere Energie U ist eine Zustandsgröße, also die Summe der Energien der einzelnen Moleküle in dem vorhandenen System. Dagegen sind die Größen ΔQ und ΔW Grenzflächenkonzepte. Wie bereits erwähnt wurde, bleiben diese nicht separat in einem System erhalten, sondern gewisse Beträge werden von außen über die Grenzfläche dem System zugeführt.
Abgeleitet aus diesem Hauptsatz erhebt man die Feststellung:
Es gibt kein Perpetuum mobile der ersten Art.
Darunter versteht man eine Maschine, die Arbeit verrichtet, ohne dass ihr von außen Energie zugeführt wird, und ohne Änderung ihrer eigenen inneren Energie.
Dieser erste Hauptsatz ist natürlich letzten Endes nichts anderes, als eine thermodynamische Verallgemeinerung des Energieerhaltungssatzes. Allerdings kommt jetzt zu der mechanischen Gesamtenergie zusätzlich eine thermische Energie hinzu. Denn die Gleichung beinhaltet in Erweiterung des Energieerhaltungssatzes eine Wärmemenge.
In der Mechanik wurde der Energieerhaltungssatz so formuliert, dass bei konservativen Systemen die Summe von kinetischer und potentieller Energie erhalten bleibt. Aber für nichtkonservative Systeme gilt, wenn beispielsweise Reibungskräfte vorliegen, ist das nicht mehr zutreffend. Solche Einschränkungen machen wir jetzt nicht mehr. Nun darf aufgrund von Reibungsvorgängen eine Wärmemenge entstehen, die nachfolgend mit berücksichtigt wird. Durch die Hinzunahme der thermischen Energie gewinnt der Energieerhaltungssatz an Bedeutung, die er bei der Betrachtung einfacher Systeme in der Mechanik nicht hatte.
Auf diese Weise erhält man eine geschickte Verallgemeinerung des Energiebegriffs.
Was kann man jetzt mit diesem ersten Hauptsatz anfangen? Und was für verschiedene Größen sind hier von Bedeutung?
Um das Thema Zustandsänderungen anschaulich zu machen, werden wir nachfolgend
einige spezielle thermodynamische Prozesse in idealen Gasen betrachten. Diese Prozesse
lassen sich im Allgemeinen leicht nachvollziehen. Und hier wird die zuvor
behandelte Wärmekapazität wieder eine Rolle spielen. Wir behandeln
zunächst „isochore Prozesse”, also solche, bei denen das Volumen
Für ideale Gase gilt:
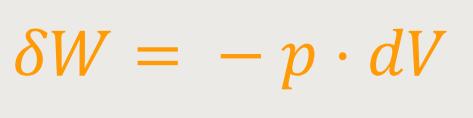
δW ist die zugeführte Arbeit
Wenn man wie hier Arbeit zuführt, wird das System komprimiert, und damit wird das dV kleiner.
In der Gleichung steht sowohl δ als auch d , um anzudeuten, dass es sich bei der Arbeit W nicht um eine Zustandsgröße handelt. Dagegen ist das Volumen V sehr wohl eine Zustandsgröße. Das δW ist vielmehr eine gewisse Arbeitsmenge, die zugeführt wird. Sie lässt sich aber nicht darstellen als die Differenz zweier Arbeitsinhalte. Beim Volumen sieht das anders aus. Die Änderung des Volumens ist tatsächlich eine Änderung zwischen zwei Volumenwerten. Während dieses δW nicht als Änderung zwischen zwei Arbeitsinhalten aufgefasst werden kann.
Man kann also einem System eine gewisse Arbeit zuführen, und damit an dem System Arbeit leisten. Anderseits kann dem System auch eine gewisse Wärmemenge zugeführt werden. Das bedeutet aber nicht, dass damit der gesamte Wärmeinhalt oder Arbeitsinhalt verändert wird. Denn die Wärmemenge und die Arbeit sind, wie mehrfach erwähnt, keine Zustandsgrößen. Dagegen ist das Volumen sehr wohl etwas, was dem System zukommt, und stellt somit eine Differenz zweier Zustandsgrößen dar, einmal vor und einmal nach der Veränderung.
Wenn man das berücksichtigt, lässt sich unter Bezugnahme des ersten Hauptsatzes entsprechend formulieren:
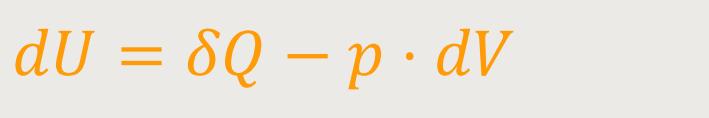
dU ist die innere Energie (das Differential daraus)
Da das Volumen

Das bedeutet wiederum, dass in diesem Fall die zugeführte Wärmemenge δQ vollständig zur Erhöhung der inneren Energie U verwendet wird. Da das Volumen konstant bleibt, kann das System keine mechanische Arbeit leisten. Dazu müsste sonst ein Kolben verschoben werden, wodurch eine Volumenänderung hervorgerufen wird. Das wurde aber als Vorgabe ausgeschlossen.
Wenn wir uns an die Betrachtung der Wärmekapazität erinnern, gilt ja für isochore Prozesse:
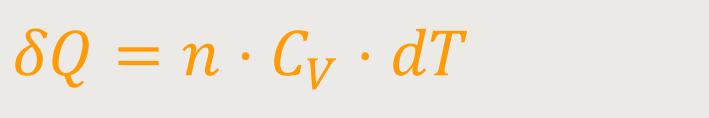
n ist die Molzahl
CV ist die Molwärme
Das Produkt aus beiden ist die Wärmekapazität.
In Erweiterung erhält man bei konstantem Volumen:
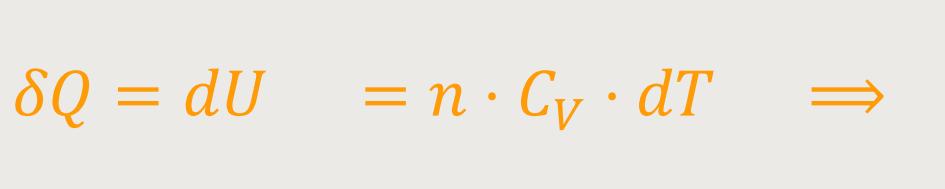
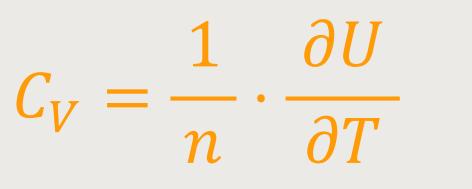
Die Molwärme ergibt sich durch Differentiation der Zustandsgröße U, also der inneren Energie nach der Temperatur. Hier ist es partiell ausgedrückt, weil die innere Energie auch von anderen Eigenschaften abhängig sein kann. Bei idealen Gasen allerdings ist sie im Allgemeinen nur von der Temperatur abhängig.
Zusammenfassend kann man bezogen auf diese Zustandsänderung sagen, dass wenn man bei isochoren Systemen eine Wärmemenge zuführt, sich diese komplett in der Vergrößerung der inneren Energie wieder findet.
Im Gegensatz dazu betrachten wir jetzt „isobare Prozesse”. Bei isobaren
Prozessen ist es so, dass der Druck
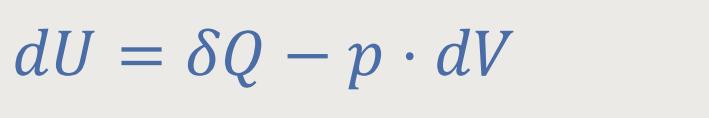
Wenn man einem System, bei dem der Druck konstant gehalten wird, eine Wärmemenge zuführt, dann wird einerseits die Temperatur zunehmen, aber andererseits wird das System auch expandieren. Also die Zuführung von Wärmemengen bewirkt zweierlei. Einerseits führt sie teilweise zu einer Erhöhung der Temperatur und damit zu einer Erhöhung der inneren Energie. Andererseits wird sie teilweise in eine Abgabe von mechanischer Arbeit umgesetzt.
Dieser Vorgang lässt sich zunächst nur etwas komplizierter ausdrücken. Man ist aber bestrebt, es dennoch in einer vergleichbar einfachen Weise darzustellen. Sodass man sagen kann, die zugeführte Wärmemenge wird auch hier vollständig zur Erhöhung einer bestimmten thermodynamischen Größe verwendet.
Um das darstellen zu können, führt man den Begriff der „Enthalpie” ein. Diese Enthalpie H ist auch eine Art innere Energie und ebenfalls eine Zustandsgröße. Ihre Beziehung lautet:
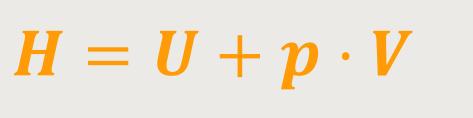
Die Enthalpie kann einen Prozess wieder ausgleichen. Dass, was man bei einem isobaren Prozess beobachtet, nämlich dass es teilweise zu einer Erhöhung der inneren Energie kommt und teilweise mechanische Arbeit abgeführt wird, bringt die Enthalpie wieder in Ordnung. Mit anderen Worten, die zugeführte Wärmemenge wird komplett in eine Erhöhung der Enthalpie umgesetzt. Warum legt man so viel Wert auf diese Formulierung?
Das hat mit den Arbeitsbedingungen der Chemiker zu tun. Beim Durchführen von chemischen Reaktionen im Labor wird unter konstantem Druck gearbeitet, nämlich unter dem normalen Atmosphärendruck. Meistens liegen dabei isobare Bedingungen vor und keine isochoren Bedingungen. Auf das Reagenzglas wirkt immer der normale Luftdruck der Atmosphäre. Und wenn chemische Reaktionen ablaufen, bleibt der Gesamtdruck des Systems konstant. Es gibt sicherlich auch Ausnahmen, aber in der Regel wird unter isobaren Bedingungen experimentiert.
Um eine möglichst einfache Argumentation zu finden, benötigt man die Beziehung der Enthalpie. Wenn man den Formalismus der Enthalpie kennt, lässt sich ihr Differential bilden:
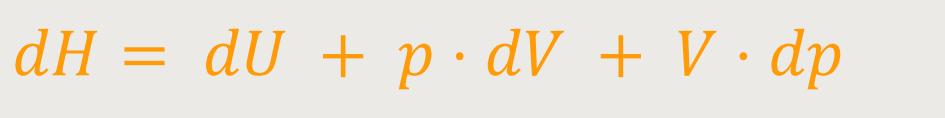
Und da bei den isobaren Prozessen der Druck p = const bleibt, ist
entsprechend
Zu Beginn hatten wir bereits formuliert, dass:
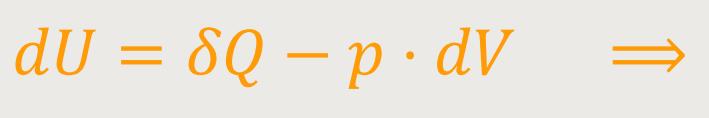
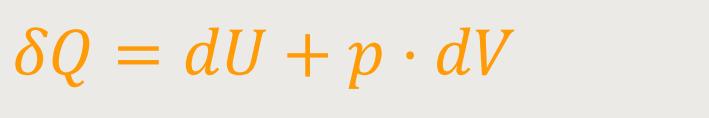
Durch Einsetzen erhalten wir:

Und damit erhält man etwas Ähnliches, wie bei der inneren Energie. Analog zu oben kann man eine vergleichbare Schlussfolgerung ziehen: Die zugeführte Wärmemenge δQ wird vollständig zur Erhöhung der Enthalpie H verwendet.
Deshalb spricht man in der Chemie auch oft von einer „Reaktionsenthalpie”. Wenn bei konstantem Druck bei irgendeiner Reaktion eine Wärmemenge auftritt, dann lassen sich die daraus ergebenden Zustandsänderungen am besten durch die Enthalpieänderung beschreiben. Denn die Enthalpieänderung ist entspricht der zugeführten Wärmemenge.
Abschließend kann man ähnlich wie bei den isochoren Prozessen noch definieren, wie sich die zugeführte Wärmemenge δQ mithilfe der Molwärme bei konstantem Druck darstellt:
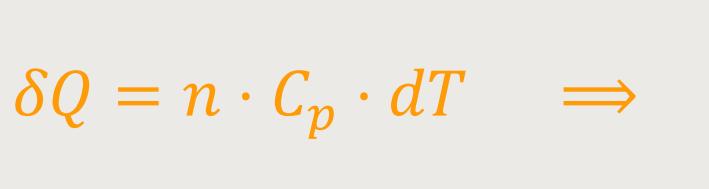
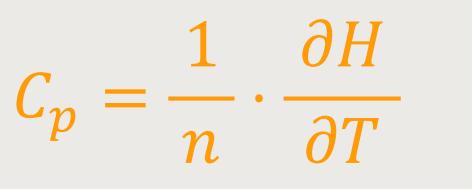
Die Molwärme ergibt sich durch Differentiation der Zustandsgröße H, also der Enthalpie nach der Temperatur. Das ist zunächst alles, was sich an dieser Stelle über die Enthalpie sagen lässt.
Jetzt werden wir „isotherme Prozesse” betrachten. In diesem Fall gilt für die
Temperatur, dass
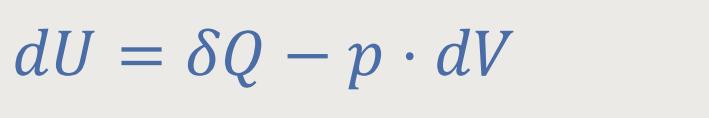
Und da wir bereits einige Terme aus der Definition der Temperatur kennen, ergibt sich damit:
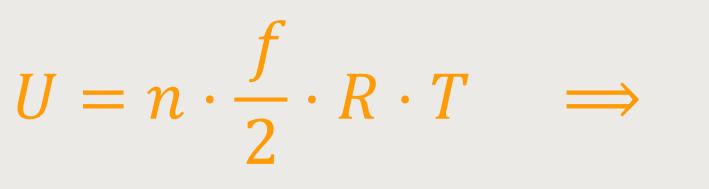
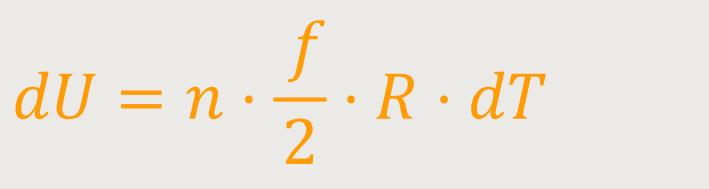
Hinweis: Man könnte auch
Weil die Temperatur konstant ist, gilt entsprechend

Wird die Temperatur in dem System konstant gehalten, bleibt auch die innere Energie des Gases konstant. Im Grunde eine ganz einfache Beziehung. Denn die Temperatur beschreibt ja die kinetische Energie pro Molekül. Wenn also die Temperatur konstant bleibt, bleibt die mittlere kinetische Energie pro Molekül ebenfalls konstant. Und daher auch in Summe über alle Moleküle.
Wenn aber
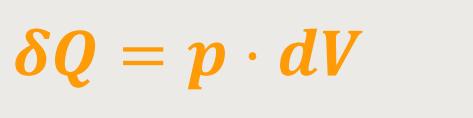
Daraus kann man wieder eine unmittelbare Schlussfolgerung ziehen. Nämlich, dass die zugeführte Wärmemenge δQ vollständig in Arbeit −δW umgewandelt wird. Und wenn die Temperatur konstant bleibt, erhält man wegen der Gültigkeit der Zustandsgleichung:

Wir erinnern uns, wenn man das grafisch in einem
⇦ Kapitel Kapitel ⇨
