Im vorherigen Kapitel hatten wir die Gaskonstante definiert. In der Chemie wird in diesem Zusammenhang meistens über mol gesprochen. Aber in der Physik hat sich der Begriff des kmol durchgesetzt. Und da man sich in der Physik auf die SI-Einheiten bezieht, jedoch die Masseneinheit das kg ist, wird deshalb das kmol als Einheit verwendet.
Wobei 1 kmol diejenige Menge einer Substanz ist, in der so viele Moleküle vorhanden sind, wie in 12 kg vom Kohlenstoffisotop 12C. Wie viele Moleküle sind das in etwa? Die Anzahl ist die sogenannte „Avogadro-Konstante”:

Demnach entspricht
Das ist einfach die Anzahl Mole, die in dem konkreten System vorhanden sind. Und demzufolge gilt für die Molekülanzahl:
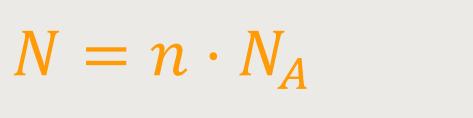
N ist die Molekülanzahl
Wenn man jetzt die Zustandsgleichung entsprechend umformuliert, ergibt sich:
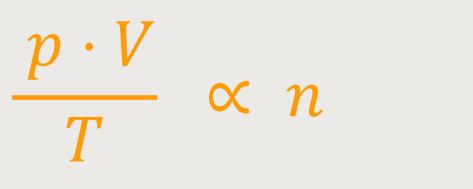
Diese Proportionalitätskonstante gilt immer, egal welches Material man verwendet. Ob das jetzt Helium ist oder Stickstoff oder was auch immer. Dementsprechend kann man auch schreiben:
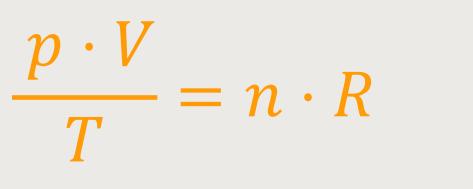
R ist eine universelle Gaskonstante
Diese allgemeine Gaskonstante lässt sich auch experimentell bestimmen:
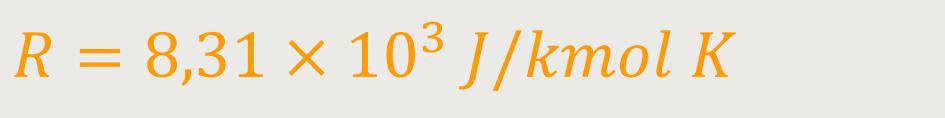
Wenn man das entsprechend wieder umformt und gleichzeitig für n einsetzt, ergibt sich:

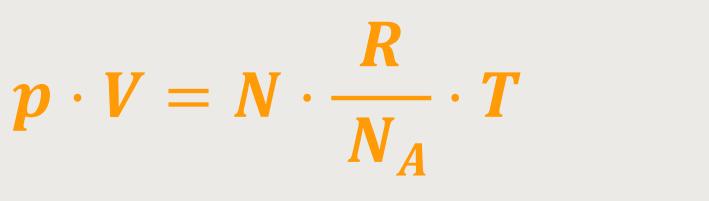
p · V entspricht also der Anzahl Moleküle
N in dem System, multipliziert mit einer Konstanten und dies
multipliziert mit der Temperatur. Diese durch Umformung entstandene Konstante
Jetzt werden wir kurz die „Wärmemenge” betrachten. Wenn man die
Temperatur eines Körpers erhöhen möchte, muss eine gewisse Wärmemenge
zugeführt werden. Hat man zum Beispiel einen kleinen Topf mit Wasser, muss nur wenig
Wärme zugeführt werden. Wenn man dagegen einen großen Topf hat, muss man
entsprechend mehr Wärme zuführen. Wenn eine Temperaturerhöhung um
ΔT erreicht werden soll, muss eine Wärmemenge
ΔQ zugeführt werden. Hierbei ist
Wenn man beispielsweise die Temperatur um 2 °C erhöhen möchte, muss die doppelte Wärmemenge zugeführt werden. Diesen Proportionalitätsfaktor sieht man generell als „Wärmekapazität” an:

Γ (Gamma) ist die Wärmekapazität des betrachteten Körpers
Je größer der Körper ist, desto mehr Wärme muss zugeführt werden, um eine bestimmte Temperaturerhöhung zu erreichen. Diese Wärmekapazität steht mit der Masse des Köpers in Wechselbeziehung. Wenn der Körper mehr Masse hat, hat es auch eine höhere Wärmekapazität.
Wie lässt sich diese zugeführte Wärmemenge konkret messen? Zunächst
bietet es sich an, die Einheit festzulegen. Historisch bedingt hatte man sich
überlegt, dass es diejenige Wärmemenge ist, die man benötigt, um
die Temperatur von
Später werden wir noch sehen, dass man diese Wärmekapazität auch auf die
Masseneinheit oder auf
Doch was versteht man eigentlich unter der Wärme? Früher dachte man, es sei ein Fluidum, das in die Materialien hineingeht. Aber bereits 1845 hat J. P. Joule dazu beigetragen, dem Thema eine andere Sichtweise zu vermitteln. Joule hatte die Idee, dass man diese Wärmemenge, die man einem Material zuführen kann, nicht nur durch Erwärmen erreichen kann, sondern auch durch Reibung. Reibung wird dadurch erzeugt, dass man eine Arbeit verrichtet.
Wie die Wärmezufuhr letztlich erfolgt, ist demnach egal. Das kann somit auch mithilfe von mechanischer Energie erfolgen. Egal, für welche Vorgehensweise man sich entscheidet, beides ist stets zueinander proportional.
Wird die Wärmemenge durch mechanische Energie zugeführt, ergibt sich für die Arbeit:
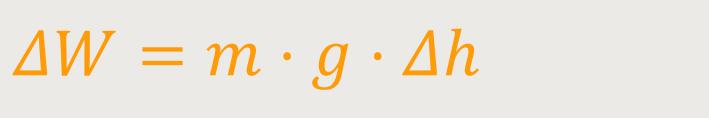
ΔW ist die verrichtete Arbeit
Es stellt sich heraus, dass die Wärmemenge stets proportional zur verrichteten Arbeit ist.

KW ist ein Proportionalitätsfaktor
Der Proportionalitätsfaktor wird auch als das Wärmeäquivalent bezeichnet. Diese Größe bleibt immer die gleiche, egal was für eine Substanz man verwendet. Sie ist definiert als:
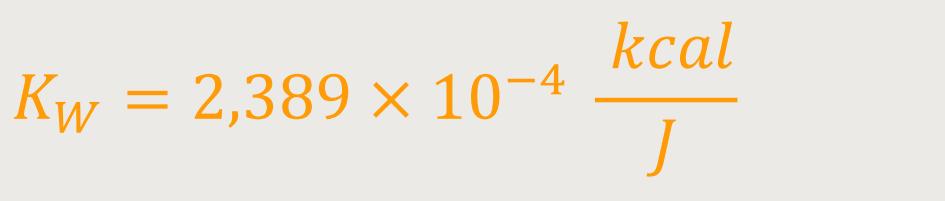
Auch das ist eine universelle Konstante, die sich experimentell bestimmen lässt.
Bei genauer Betrachtung erkennt man, dass die Wärme, die zugeführt wird und die Arbeit, die verrichtet wird, das gleiche ist. Wie lässt sich das untermauern? Eine Hilfe dabei ist, den molekularen Charakter der Materie zugrunde zu legen. Nehmen wir der Einfachheit halber eine Flüssigkeit her, die aus zahllosen Molekülen besteht. Wird jetzt diese Flüssigkeit durch einen Rührstab in Bewegung versetzt, wird die von außen geleistete Arbeit in der Flüssigkeit umgesetzt. Die Arbeit wird quasi übertragen in die ungeordnete Bewegung der Flüssigkeitsmoleküle.
Hat man beispielsweise eine konvektive Bewegung einer Flüssigkeit, dann ist die Energie in dem System geordnet. Wenn aber die Flüssigkeit durch Reibung zum Stillstand kommt, dann ist die Energie nicht verloren gegangen, sondern sie wurde umgesetzt in eine Erhöhung der Energie der ungeordneten Bewegung der Flüssigkeitsmoleküle. Dementsprechend lässt sich folgende Schlussfolgerung ziehen:
Wärme ist die Energie der ungeordneten Bewegung der Moleküle eines Körpers.
Insofern kann man die Wärmemenge als kinetische Energie auffassen. In diesem Fall benötigt man keine eigene Einheit mehr für die Wärmemenge. Man misst sie einfach als kinetische Energie. Das bedeutet wiederum, dass auch der Proportionalitätsfaktor überhaupt nicht benötigt wird. Wenn man aufgrund der experimentellen Befunde erkennt, dass die beiden Größen, Wärmemenge und Energie, wesensgleich sind, dann kann man den Faktor einfach dimensionslos setzen:

Es ist nur eine Frage der Einheitenfestlegung. Wir erinnern uns, die Einheit für
die Wärmemenge ΔQ wurde in Kalorie festgelegt. Wobei
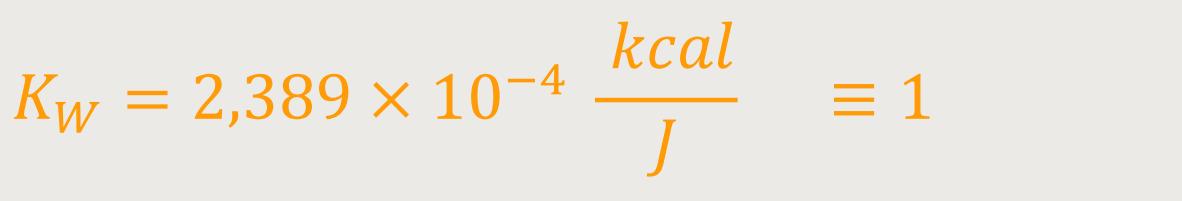
Was ergibt sich daraus, wenn man diesen Weg beschreitet? Dann lässt sich sofort
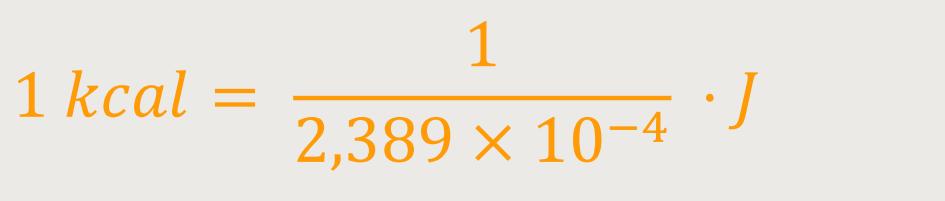
Damit wird die absolute Basiseinheit der Wärmemenge degradiert zu einer inkohärenten
Energieeinheit. Die kcal kann nach wie vor verwendet werden, als Einheit
der Energie oder Wärmemenge. Trotzdem bleibt man natürlich bei
J als der
Jetzt lässt sich auch nachvollziehen, warum so viel Arbeit verrichtet werden muss, um
zum Beispiel
Ein Medium aus Gas kann man sich zusammengesetzt aus einzelnen Molekülen vorstellen. Diesen Molekülen kann man auch sogenannte „Freiheitsgrade” zuordnen. Das sind Freiheitsgrade der Translation, der Rotation und der Schwingung. Ein Molekül kann sich somit in drei Raumrichtungen translatorisch fortbewegen, es kann sich aber auch um drei Achsen drehen und es kann Schwingungsvorgänge durchführen. Wir wollen diese Freiheitsgrade aber unter dem Aspekt idealer Gase betrachten.
In diesem Zusammenhang legen wir gewisse Voraussetzungen fest. Wir werden die Moleküle praktisch als punktförmig annehmen, und sie sollen auch keine inneren Schwingungen haben. Damit bleiben für diese Moleküle nur die drei Freiheitsgrade der translatorischen Bewegung übrig. Andere werden wir hier jetzt nicht betrachten. Unter sehr allgemeinen Voraussetzungen verteilt sich die Molekülenergie im Mittel gleichmäßig auf alle Freiheitsgrade. Wie kann man jetzt die Gaseigenschaften mit einem derartigen Modell beschreiben?
Aus der Punktmechanik kennen wir bereits den Ausdruck, dass die Kraft als die zeitliche Ableitung des Impulses dargestellt werden kann:
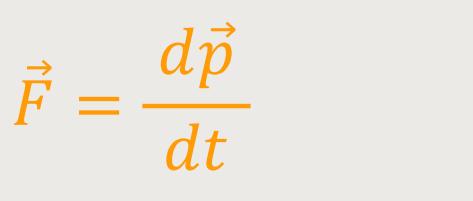
Möchte man solche Punktmassen weiter beschreiben, kann man die Kraft, die von einem
solchen Gas ausgeübt wird, auch als einen Impulsübertrag festlegen.
Wenn wir beispielsweise einen Behälter betrachten, dann bewirkt die Kraft eines Gases
auf die Innenoberfläche des Behälters einen Impulsübertrag.
Wenn so ein Teilchen mit einem Impuls gegen eine Wandfläche trifft, kann es zu einem
elastischen Kontakt kommen. Dann fliegt es mit dem gleichen Impuls wieder in der Gegenrichtung
zurück. Das heißt, das Teilchen hat zweimal den Impuls auf die Oberfläche
übertragen. Von + hat es auf −
hat es auf − gewechselt. Das bedeutet, um zwei
gewechselt. Das bedeutet, um zwei 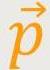 hat es sich geändert. Diese zwei
hat es sich geändert. Diese zwei
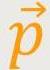 wurden auf die Grenzfläche
übertragen. Somit wurde eine Kraft auf diese Fläche ausgeübt.
wurden auf die Grenzfläche
übertragen. Somit wurde eine Kraft auf diese Fläche ausgeübt.
Dementsprechend kann man den Druck des Gases, der auf eine derartige Fläche wirkt, beschreiben als:
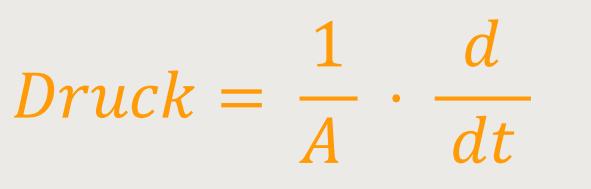

A ist die Oberfläche
Dazu hat Daniel Bernoulli verschiedene Untersuchungen gemacht. Und mit seinen Überlegungen lassen sich einige Bezeichnungen festlegen (siehe unten):
Obige Gleichung beinhaltet den auf die Fläche übertragenen Impuls. Was versteht man unter dieser Größe?
Nehmen wir zum Beispiel ein Molekül in einem Volumen, welches sich in der Nähe einer Oberfläche aufhält. Dieses Molekül kann sich translatorisch zu allen Seiten der drei Raum-Richtungen bewegen. Letztlich wird das Molekül aber nur 1/6 aller seiner Bewegungen in Richtung der Oberfläche durchführen.
Nun greifen wir uns einen Teilbereich dieser Oberfläche heraus, und bezeichnen
diesen Flächenausschnitt mit A. Das Molekül bewegt sich
mit der Geschwindigkeit  auf diese
Teilfläche zu. Aus dieser
auf diese
Teilfläche zu. Aus dieser
Gleichzeitig erhält man die Stoßanzahl der Moleküle auf die Fläche
A in der Zeit t. Das sind nämlich alle
Moleküle in dem Quader, die sich gerade um diese Strecke
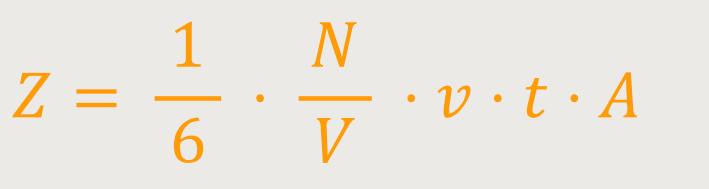
Z ist die Stoßanzahl der Moleküle
Nach statistischen Abschätzungen beträgt die Stoßanzahl somit
1/6 der Anzahl aller Moleküle im Quader. Damit erhält man den
auf die Oberfläche A übertragenen Impuls. Der
Impulsübertrag für

m · v ist der Impuls des Moleküls
Das Molekül trifft zunächst auf die Oberfläche und geht anschließend mit dem gleichen Impuls wieder in der Gegenrichtung zurück.
Dementsprechend ist der Impulsübertrag für alle Moleküle:

Wenn man in die Gleichung für den Druck entsprechend einsetzt, ergibt sich:
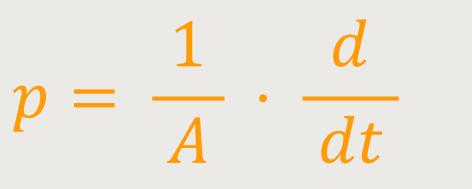
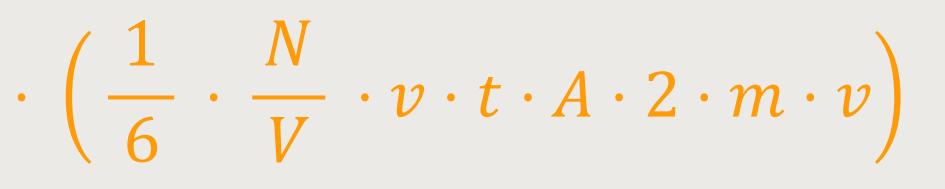
A ist die jeweils betrachtete Teilfläche
Letztlich verbleibt nach Wegkürzen in der Gleichung:
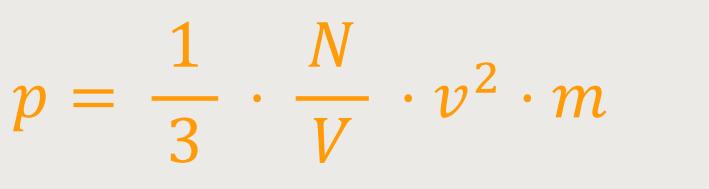
Das ist der instantane Druck aufgrund des Impulsübertrages.
Abschließend führt man noch eine Mittelung durch, weil sich die Geschwindigkeit der Moleküle noch während der Bewegung ändern wird. Dann erhält man entsprechend der festgelegten Bezeichnungen:
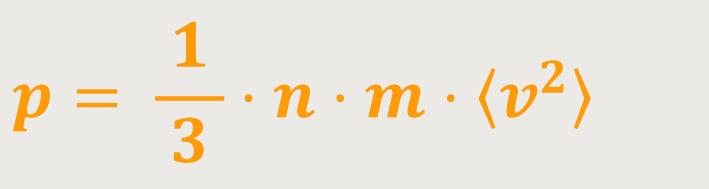
Das ist die berühmte Grundgleichung von Daniel Bernoulli.
⟨ v²⟩ ist das Quadrat der mittleren Geschwindigkeit der Moleküle
Diese Beziehung ist die entscheidende Ausgangsbedingung für die statistische Interpretation der Bewegung der Gasmoleküle und letztlich der Temperatur.
⇦ Kapitel Kapitel ⇨
