Was wird eigentlich physikalisch mit dem Parameter Temperatur beschrieben? Bei diesen Überlegungen spielen die Gase, und insbesondere die idealen Gase, eine Sonderrolle. Die Gase haben nämlich die Eigenschaft, dass die Wechselwirkungen der Gasmoleküle praktisch vernachlässigbar sind. Es kommt bei Gasen nur dann zu einer Wechselwirkung, wenn zwei Moleküle miteinander kollidieren.
Ihre Temperaturabhängigkeit ist besonders anschaulich und einfach zu beschreiben. Deswegen lässt sich aufgrund dieser Abhängigkeit auch die Temperatur sehr genau bestimmen. Es gibt zwei Gesetzmäßigkeiten, die man in diesem Fall für die idealen Gase gefunden hat. Diese Gesetzmäßigkeiten führen zur sogenannten „Zustandsgleichung idealer Gase”.
Unter „idealen Gasen” versteht man zunächst einmal hinreichend verdünnte Gase. Zur weiteren Beschreibung idealer Gase eignen sich Edelgase, auch Stickstoff oder Luft. In diesem Zusammenhang gibt es zwei experimentelle Befunde.
Um das zu veranschaulichen verwendet man ein System, genauer gesagt einen zylinderförmigen Körper, in welchem ein Kolben bewegt werden kann, ähnlich wie bei einer Luftpumpe. In einer solchen Druckkammer befindet sich das Gas, welches untersucht werden soll. Und dieses Gas hat einen bestimmten Druck, den man mit einem Druckmanometer messen kann. Wenn man den Durchmesser dieses Zylinders und auch den Hub des Kolbens kennt, lässt sich das Volumen der Kammer berechnen.
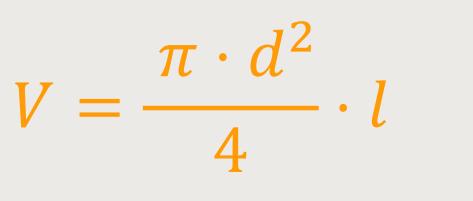
Besonders hilfreich ist es, wenn man den Hub eines solchen Kolbens auf einer graduierten Skala ablesen kann. Auf diese Weise lässt sich beobachten, wie sich der Druck ändert, wenn das Volumen verändert wird. Was wird zum Beispiel mit dem Druck passieren, wenn man Luft im Kolben, bei einem atmosphärischen Druck von 1 bar, auf die Hälfte des Volumens komprimiert?
Im Experiment zeigt sich, dass der Druck bei Halbierung des Volumens auf das Doppelte ansteigt. Was bedeutet das?
Wenn man das Produkt aus den Größen Druck · Volumen betrachtet, und man einerseits das Volumen halbiert, wobei sich gleichzeitig der Druck verdoppelt, dann ergibt sich daraus, dass das Produkt konstant bleibt:
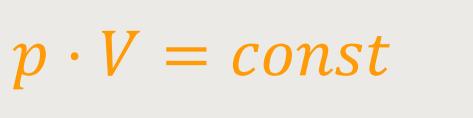
Diese Aussage ist das berühmte Boyle-Mariottesche-Gesetz.
Hierbei ist allerdings zu berücksichtigen, dass obiges Experiment bei konstanter Raumtemperatur durchgeführt wurde. Wenn die Kompression langsam genug vonstatten geht, findet immer ein Austausch mit der umgebenden Temperatur statt. Man hat im Wesentlichen während des ganzen Vorgangs ständig Gleichgewichtszustände durchlaufen.
Wir erinnern uns, der Parameter der Temperatur wird dadurch charakterisiert, dass wenn man eine Zeit lang wartet, um ein thermodynamisches Gleichgewicht herzustellen, man schließlich feststellt, dass zwei in Kontakt befindliche Körper auf der gleichen Temperatur sein werden. Ein solches Durchlaufen einer Serie von Gleichgewichtszuständen, nennt man generell in der Thermodynamik einen „quasi statischen” Vorgang, der jederzeit reversibel ist.
Das gilt allerdings nur für ideale Gase. Das Medium Gas ist nicht immer und unter allen Umständen ideal, sondern nur in gewissen Bereichen. Denn wenn das Gas zu sehr komprimiert wird, kommt man in die Nähe eines Phasenübergangs. Dann beginnt das Gas zu kondensieren, und man hat nicht mehr diese einfachen Voraussetzungen. Für unsere Betrachtung befinden wir uns weit genug weg von irgendwelchen Phasenübergängen. Wenn sich also ein Gas wie dieses Boyle-Mariotte-Gesetz verhält, dann nennt man es ein ideales Gas.
Wenn p · V = const, dann entspricht die Gleichung einer Hyperbel.
Aber noch spannender wird es für die zweite Gesetzmäßigkeit. Was wird passieren, wenn man das Experiment jetzt bei unterschiedlichen Temperaturen macht? Nun, das Ergebnis ist relativ einfach. Wenn man die Temperatur erhöht, wird sich einfach nur die Konstante ändern. In einem Diagramm wird die Hyperbel, entsprechend der konstanten Temperaturunterschiede, versetzt angeordnet sein. Daher nennt man eine solche Kurve eine „Isotherme”, weil die Temperatur konstant bleibt. Aus diesem Grund werden solche Experimente auch langsam durchgeführt. Denn wenn man zu schnell komprimiert, wird das Gas erhitzt, und wenn man zu schnell expandiert, kühlt das Gas ab.
Um zu veranschaulichen, was bei verschiedenen Temperaturen passiert, verwendet man wieder ein System eines zylinderförmigen Körpers, in welchem ein leicht beweglicher Kolben vorhanden ist. In der Druckkammer ist nach wie vor das Gas, welches man untersuchen möchte. Und dieses Gas hat jetzt eine bestimmte Temperatur, die mit einem Temperatursensor gemessen wird. Das Gasvolumen bleibt ständig unter konstantem Druck. Auch hier lässt der Abstand des Kolbens auf einer graduierten Skala ablesen. Nun wird das System aufgeheizt, wobei sich der Kolben ohne Einwirkung von außen reibungsfrei bewegen kann. Was passiert mit dem Kolben, wenn zum Beispiel Luft, bei einem atmosphärischen Druck von 1 bar, in der Druckkammer erhitzt wird?
Im Experiment zeigt sich, dass sich der Kolben bei konstantem Druck, aber einer Erhöhung
der Temperatur so bewegt, dass sich das Volumen linear ausdehnt. Überträgt
man die Volumina und die entsprechenden Temperaturen in ein
Bei
Und geht die Temperatur runter, in Richtung immer kleinere Volumina, gelangt man schließlich an einen Punkt, an dem das Ende erreicht ist. Man ist dann am Ende angelangt, wenn sich die Gasmoleküle gar nicht mehr bewegen. Sie liegen sprichwörtlich nur noch herum. Und da die Moleküle ein sehr viel kleineres Eigenvolumen haben, als die Volumina im Experiment, kann man das praktisch vernachlässigen. Irgendwann wird die Situation natürlich grenzwertig, weil ab einem bestimmten Zeitpunkt flüssige Luft entsteht. Wir gehen aber nach wie vor davon aus, dass es weitestgehend ein ideales Gas bleibt.
Würde man jedoch Helium statt Luft verwenden, könnte man eine noch tiefere Temperatur erreichen, bis es letztlich zu einer Kondensation kommt.
Wenn man das sehr genau interpoliert, kommt man letztlich auf eine Temperatur von
Gerade bei der Beschreibung molekularer Modelle ist es hilfreich sich gedanklich vorzustellen, wie beispielsweise Gasmoleküle in einem System ungeordnet herumfliegen. Und man kann gut nachvollziehen, dass die Temperatur eine Rolle dabei spielt, wie hektisch sich die Moleküle bewegen. Aber letzten Endes geht es hierbei um die kinetische Energie der Moleküle. Und wenn die Temperatur in dem System nach und nach sinkt, wird auch die kinetische Energie weniger und weniger. Mehr als gar keine kinetische Energie kann man logischerweise nicht erreichen, denn die kinetische Energie ist positiv definiert. Für obigen experimentellen Befund erhält man wieder eine Gleichung. Und da es hierbei eine lineare Beziehung gibt, erhält man:

Diese Gleichung wird auch als Gay-Lussac-Gesetz bezeichnet.
Dieses Gesetz gilt jedoch nur bei
γV
ist ein Vorfaktor mit einem bestimmten Wert
tC
ist die Temperatur in °C
Und wenn man das tC gleich
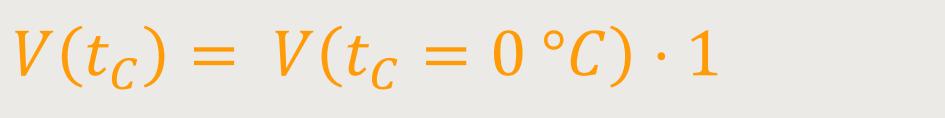
In diesem Fall kreuzt die Gerade als lineare Funktion die Volumen-Achse bei


Damit ergibt sich:

γV ist der Volumen-Spannungskoeffizient
Doch wie sieht die Situation aus, wenn das Medium aus einem anderen Gas besteht? Man könnte
annehmen, die Steigung der linearen Funktion verläuft dann flacher oder steiler. Doch da gibt
es jetzt einen erstaunlichen Umstand. Es ist nämlich egal, welches ideale Gas man
verwendet. Solange man einen linearen Zusammenhang hat, liegt der absolute Nullpunkt
immer bei
Es lässt sich im Gegenzug natürlich auch die andere Beziehung für den Druck aufzeigen:

In diesem Fall ist
An dieser Stelle kann man eine Überlegung anstellen. Wenn man mit der Temperatur
nicht tiefer als diesen absoluten Nullpunkt kommt, dann könnte man doch einfach die
Skala verschieben. Eine Temperaturänderung von

T ist die absolute Temperatur [Kelvin]
Welchen Vorteil hat diese Definition? Wenn die absolute Temperatur bei
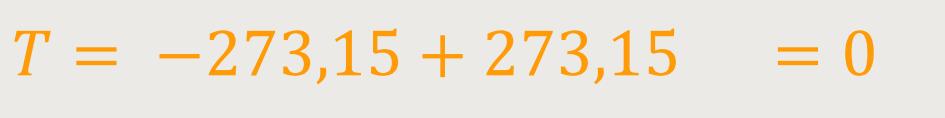
Mit anderen Worten, an dem Punkt, an dem die Moleküle quasi nur noch herumliegen
und keine kinetische Energie mehr haben, liegt jetzt die Temperatur Null.
Das ist im Grunde nur eine rationale Überlegung. Die Temperaturdifferenzen
sind nach wie vor vorhanden, aber man hat die Skala verschoben. Sodass der (absolute)
Nullpunkt jetzt bei
Im Nachfolgenden werden wir diese Definition verwenden, um damit die Zustandsgleichung für ideale Gase abzuleiten. Im Umkehrschluss werden wir berücksichtigen, wenn sich ein Gas so verhält, dass es dieser Gleichung genügt, dann ist es ein ideales Gas. Und wenn es sich nicht so verhält, befinden wir uns in der Nähe von Phasenübergängen.
Jetzt formen wir die obige Gleichung ...
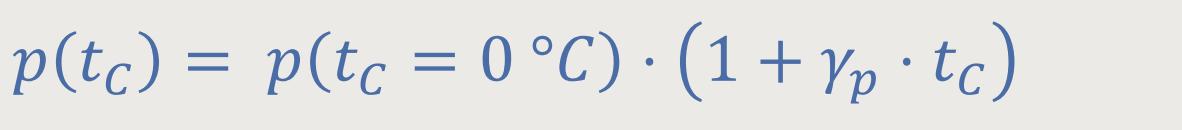
... um, indem wir für Grad Celsius jetzt Kelvin einsetzen:
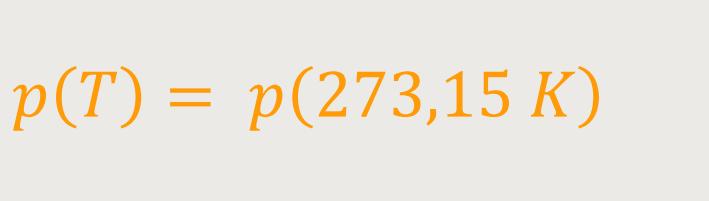
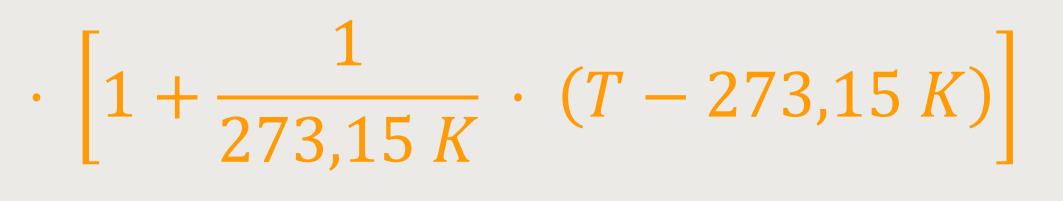
Was kommt nun dabei heraus? Durch nochmaliges Umformen ergibt sich:
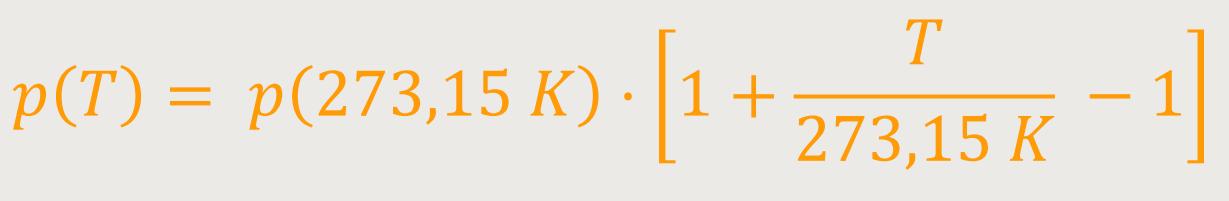
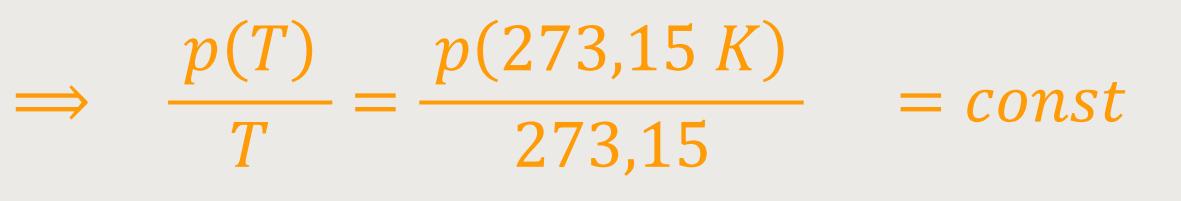
Nach wie vor gilt für das Volumen
Damit erhalten wir eine Beziehung, die beides erfüllt:
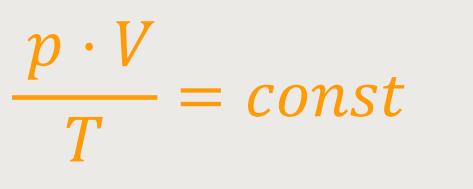
Diese Konstante ist ein Maß dafür, wie viel Moleküle in diesem System vorhanden sind. Also wie groß die Molekülanzahl in dem Gas ist. Und dabei ist nun unerheblich, welches Gas man verwendet. Daher wird diese Konstante auch geschrieben als:
n · RR ist die allgemeine Gaskonstante
n ist die Molzahl
Man muss allerdings dazu sagen, dass diese Gaskonstante ein experimenteller Befund ist.
Und 1 Mol ist diejenige Menge eines Gases oder einer Substanz, in
der so viele Moleküle vorhanden sind, wie in
Und wenn man das entsprechend einsetzt, erhält man:
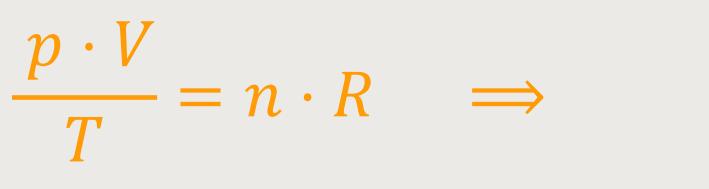

Das ist die Zustandsgleichung der idealen Gase.
⇦ Kapitel Kapitel ⇨
