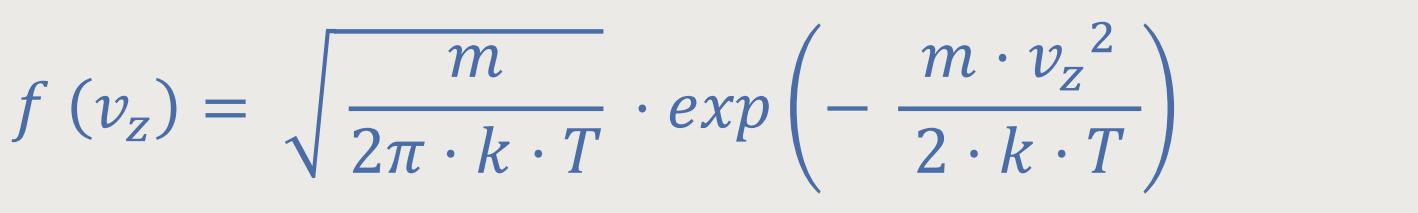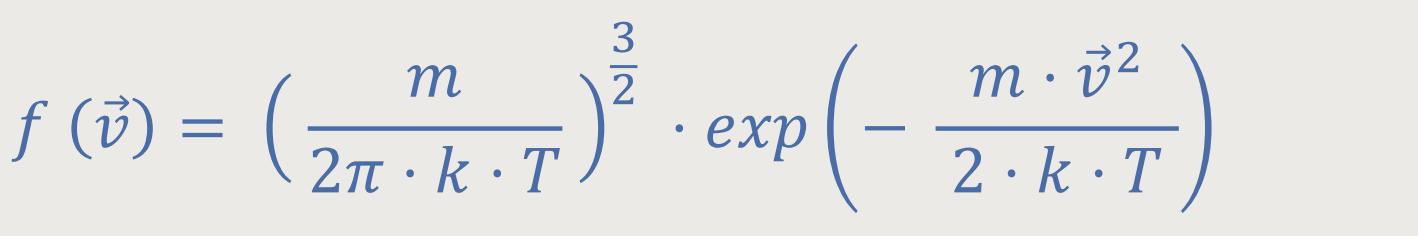Wie schaut denn nun die Verteilung der Geschwindigkeitsbeträge aus?
Im vorherigen Kapitel hatten wir die normierte Wahrscheinlichkeitsdichte
für das Auftreten der
In dem Exponenten wird mit
Da man aber alle drei Raumrichtungen für die Bewegung eines Moleküls berücksichtigen muss, kann man sich sozusagen die Spitze des Geschwindigkeitsvektors in einem kleinen Volumenelement, quasi dem Geschwindigkeitsraum vorstellen.
Man gibt dem Geschwindigkeitsvektor einen gewissen Bereich, in dem er schwanken kann. Und die Wahrscheinlichkeit, dass der Vektor gerade so liegt, dass die Spitze des Geschwindigkeitsvektors in einem solchen Volumenelement eines hypothetischen Geschwindigkeitsraums liegt, ist dann gegeben als:
Und hier war f ( )
· dvx · dvy · dvz
die Wahrscheinlichkeit, dass:
)
· dvx · dvy · dvz
die Wahrscheinlichkeit, dass:
die x-Komponente
die y-Komponente
die z-Komponente
Wobei vx , vy , vz die Kantenlängen eines solchen kleinen Würfels in einem Geschwindigkeitsraum entsprechen.
Und nachdem das lauter
Und wenn man die Exponentialfunktion für jede Komponente miteinander
multipliziert, dann addieren sich entsprechend die Exponenten. Damit erhält man
letztlich auch das
 ²
² ²
natürlich dem
²
natürlich dem
Man kann hier schon erkennen, dass dieses
Wesentlich ist immer bei diesen Funktionen, diese mithilfe der Vorfaktoren so zu normieren, dass die Kurven in einem Graphen, und die sich daraus ergebenen Flächen, immer dem Wert 1 entsprechen. Ähnlich wie bei der Gaußschen Verteilung erhält man dann entsprechende Kurven. Wobei der Vorfaktor so gewählt wird, dass ein entsprechendes Integral gebildet wird, damit sich dann ergibt:
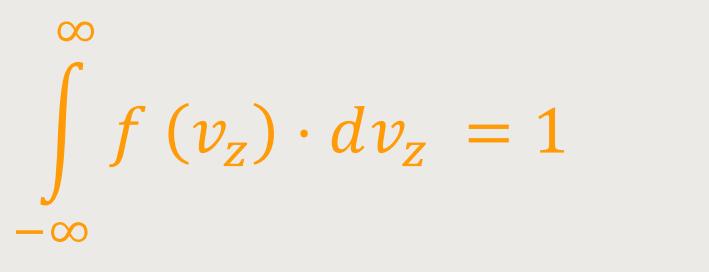
Dadurch erhält man auch eine Vergleichbarkeit der verschiedenen
Temperaturkurven. Das
Es geht aber immer noch um die Frage, wie schnell sind denn nun diese Moleküle? Was ist
jetzt wirklich so eine typische mittlere Geschwindigkeit, mit der die Moleküle
unterwegs sind? Wir haben bisher immer nur über Komponenten gesprochen. Entweder
die
So wie uns, hat es seinerzeit auch James Clerk Maxwell besonders interessiert, wie es mit den Geschwindigkeitsbeträgen aussieht? Die können nämlich nicht kleiner als Null werden. Insofern muss die Verteilungsfunktion anders dargestellt werden. Und zwar in einer solchen Form, dass man mehr Einblick in die tatsächlichen Geschwindigkeitsbeträge erhält.
Hierzu kann man die Geschwindigkeitsvektoren ähnlich wie die Ortsvektoren in einem Raum auftragen. Die „Ausschläge” sind dann die Spitzen des Geschwindigkeitsvektors. Das ist aber nicht wirklich ein Raum der Anschauung, sondern nur eine gedachte Möglichkeit, die Geschwindigkeitsvektoren zu visualisieren.
Wenn man so vorgeht, verbreitet sich der Geschwindigkeitsraum von einem
Ursprung aus. Genau gesagt, ein Geschwindigkeitsvektor
 zeigt von einem Ursprung mit dessen
Spitze in Richtung eines kleinen Würfels. Die räumlichen Komponenten dieses Würfels
entsprechen dvx , dvy
und dvz. Anschließend analysiert man diejenigen
Geschwindigkeiten, bei denen die Pfeilspitze im Inneren des
Würfels liegen. So erhält man alle Geschwindigkeiten, die in Betracht kommen,
und dieses
zeigt von einem Ursprung mit dessen
Spitze in Richtung eines kleinen Würfels. Die räumlichen Komponenten dieses Würfels
entsprechen dvx , dvy
und dvz. Anschließend analysiert man diejenigen
Geschwindigkeiten, bei denen die Pfeilspitze im Inneren des
Würfels liegen. So erhält man alle Geschwindigkeiten, die in Betracht kommen,
und dieses
 )
· dvx · dvy
· dvz
)
· dvx · dvy
· dvz
Natürlich hat so ein gedachter Raum gewissermaßen auch ein Volumen. Denn
Diese Idee des Geschwindigkeitsraums lässt sich in einer sehr praktischen Art und Weise anwenden. Jetzt kann man sich überlegen, wie verhält es sich, wenn man einen bestimmten Geschwindigkeitsbetrag annimmt. Wenn man nichts als nur diesen Betrag vorgibt. Wie groß wird dann die Wahrscheinlichkeit dafür sein, dass die Geschwindigkeit der Moleküle einen gewissen Betrag hat, und zwar unabhängig davon, wohin der Vektor zeigt. Um das zu visualisieren, legt man jetzt in diesem Geschwindigkeitsraum rund um den Ursprungspunkt eine Kugelschale, also keinen Würfel wie oben, sondern eine geschlossene Kugelschale.
Wenn jetzt ein Geschwindigkeitsvektor so liegt, dass seine Spitze gerade in
dieser Kugelschale hineinragt, dann bedeutet das, egal wohin er zeigt, dass der Betrag
des Geschwindigkeitsvektors zwischen einem gewissen
Das Volumen in dem Geschwindigkeitsraum gibt ja an, wie groß die Wahrscheinlichkeit ist. Worauf es jetzt ankommt ist, das nicht mehr mit dem Volumen eines Würfels zu multiplizieren, sondern mit dem Volumen der Hohlkugelschale. Es geht also darum, über diese Kugelschale zu integrieren.
Die Kugelschale hat im Geschwindigkeitsraum ein Volumen von:
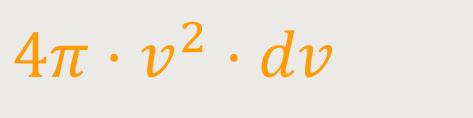
Um auf die Verteilungsfunktion der Geschwindigkeitsbeträge zu kommen, ergibt sich entsprechend:
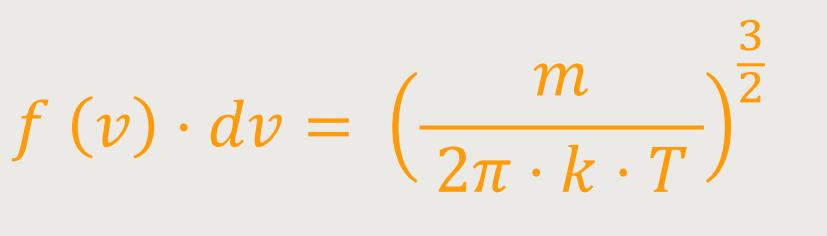
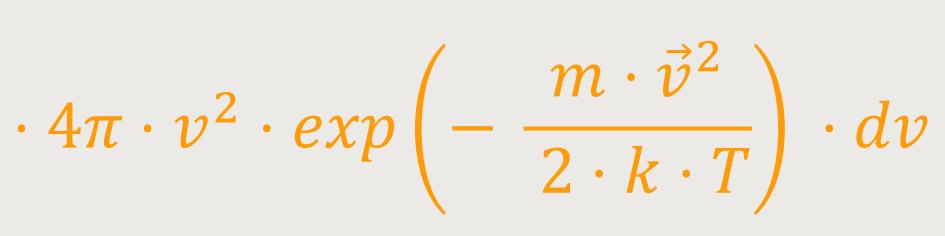
Und das nennt man die Maxwell-Boltzmann-Verteilung.
Diese Funktion gibt jetzt die Wahrscheinlichkeit an, dass der
Geschwindigkeitsbetrag zwischen
Bei der Funktion wird mit einem Intervall der Geschwindigkeitsbeträge multipliziert. Das heißt, die Geschwindigkeit, bei der die Wahrscheinlichkeitsdichte-Funktion maximal ist, ist die wahrscheinlichste Geschwindigkeit vw. Da die Verteilungsfunktion im Diagramm aber auf der einen Seite quadratisch aufsteigt und nach Erreichen der maximalen Geschwindigkeit auf der Gegenseite wieder exponentiell abfällt, ergibt sich somit eine unsymmetrische Funktion.
Aus diesem Grund wird die mittlere Geschwindigkeit immer auf der Seite des
exponentiellen Teils liegen, leicht versetzt zur maximalen Geschwindigkeit. Diese
mittlere Geschwindigkeit teilt die Gesamtfläche unterhalb der
Verteilungsfunktion in zwei gleichgroße Teilflächen. Das ist dann der
arithmetische Mittelwert, bzw. die mittlere absolute Geschwindigkeit
Die wahrscheinlichste Geschwindigkeit vw wird definiert als:
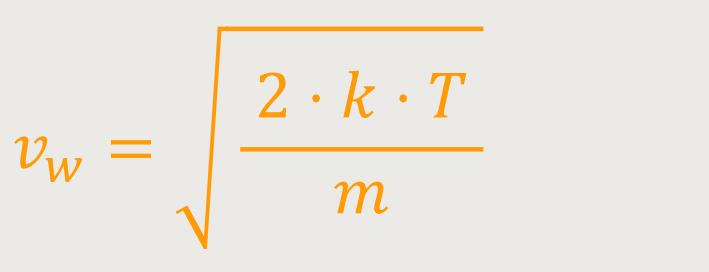
m ist die Masse eines Moleküls
Die mittlere absolute Geschwindigkeit
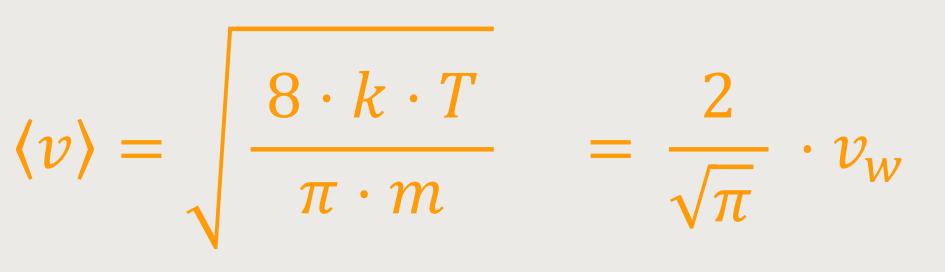
Die Wurzel (√) aus dem mittleren Geschwindigkeitsquadrat √⟨ v²⟩ wird definiert als:
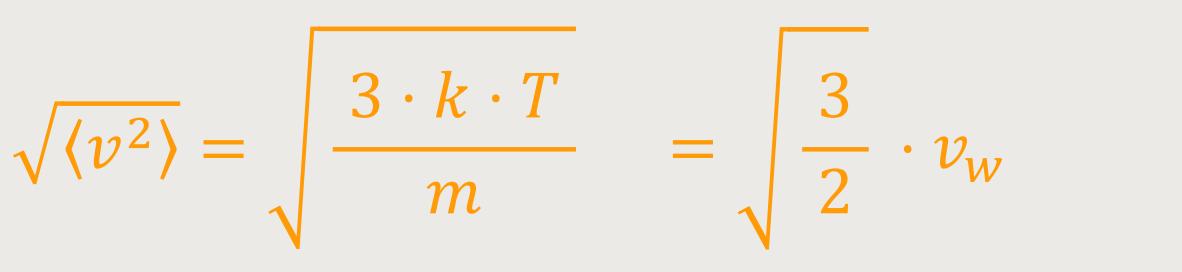
Damit ist es möglich, die realen Geschwindigkeiten eines Moleküls zu
ermitteln. Die Moleküle von Stickstoff(N2) haben zum Beispiel bei
300 K eine mittlere Geschwindigkeit von
An dieser Stelle lässt sich überprüfen, ob der Ausdruck für die Wurzel (√) aus dem mittleren Geschwindigkeitsquadrat mit der vorherigen Betrachtung übereinstimmt. Dort wurde die Temperatur mit der mittleren kinetischen Energie eines Gasmoleküls in Verbindung gebracht. Um das auch hier ausrechnen zu können, muss man obige Gleichung über das mittlere Geschwindigkeitsquadrat nur quadrieren und anschließend durch 2 dividieren. Dann erhält man:
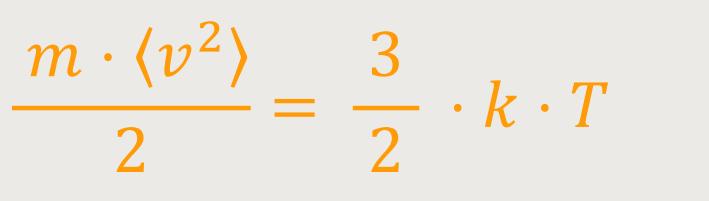
Diese Beziehung ist genau das, was wir bereits für die Temperaturdefinition
erarbeitet haben. Das entspricht genau der mittleren kinetischen Energie eines Moleküls
mit
Wie bereits angesprochen, gibt es natürlich auch Fluktuationen in der Thermodynamik. Einige Moleküle werden in ihrer Geschwindigkeit weit vom Durchschnitt abweichen. Solche Fluktuationen können aber nur mithilfe der Mittelwerte nicht beschrieben werden. Dennoch kann man aus der Betrachtung des sogenannten „Verteilungsschwanzes” in einem Diagramm etwas ableiten.
Es gibt nämlich verschiedene Vorgänge, die erst jenseits einer gewissen Energie ausgelöst werden, wie beispielsweise gaschemische Reaktionen. Wenn man wissen will, ob diese Reaktionen mit irgendeiner Rate ablaufen werden, sollte man abschätzen können, wie viele Moleküle es geben wird, die zufällig eine solche Energie bekommen, die dann groß genug ist, um diese Reaktion auszulösen. Laut Mittelwert könnte das ja nie passieren. Aber wenn man die gesamte Verteilungsfunktion zugrunde legt, gibt es dann doch eine gewisse Wahrscheinlichkeit, dass etwas passiert.
Oder wenn darum geht, Elektronen aus einer Metalloberfläche herauszuschlagen. In einem solchen Fall kommt es wieder darauf an, ob die Energie der auftreffenden Moleküle groß genug sein wird, um das zu bewerkstelligen. Selbst wenn die Mittelwerte keinen Hinweis darauf geben, gibt es dennoch ein paar Moleküle, oder Atome mit hoher Energie, die ein Atom aus der Oberfläche herauslösen. Das heißt, eine solche Rate lässt sich mithilfe von Mittelwerten überhaupt nicht beschreiben, wohl aber mit den Verteilungsfunktionen. Das ist das Wichtige an diesen Funktionen.
Allerdings befinden sich in unserer Luft so viele Moleküle, dass diese ständig miteinander zusammenstoßen. Wie groß ist denn die Distanz, die so ein Molekül überhaupt zurücklegen kann, bevor es wieder mit einem anderen zusammenstößt?
Um diese Frage zu beantworten, betrachtet man die mittlere freie Weglänge.
Das erste, was wir in diesem Zusammenhang untersuchen wollen, ist der Stoßquerschnitt. Dafür approximiert man jetzt die Moleküle als elastische Kugeln mit Radius r₁ und r₂, die dann zwei Stoßpartner bilden. Man nimmt in der Regel an, dass zwei unterschiedliche Stoßpartner aufeinander treffen. Durch die Elastizität kann man dann in vereinfachter Form einen Stoßquerschnitt definieren.
Dieser Stoßquerschnitt entspricht einer Kreisfläche, dessen Radius
aus zwei aneinandergesetzten Einzelradien
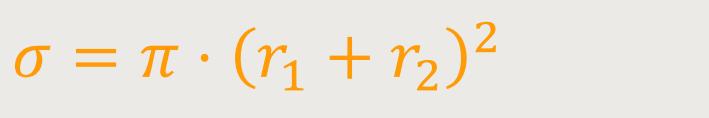
σ ist der Stoßquerschnitt
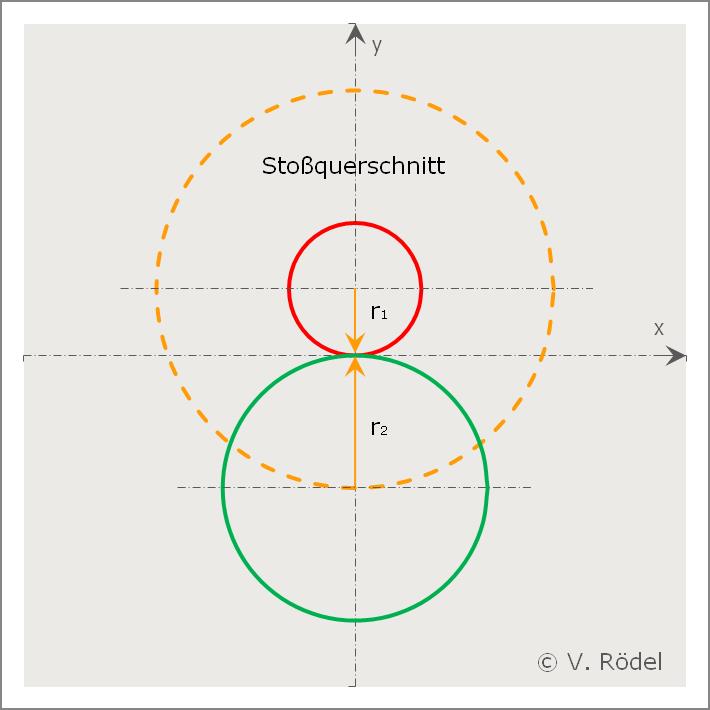
Abb.: Der Stoßquerschnitt zweier Moleküle
Immer wenn der Mittelpunkt des zweiten Moleküls innerhalb eines Stoßquerschnittes liegt, kommt es zu einem Zusammentreffen der Moleküle. Um jetzt die mittlere freie Weglänge zu berechnen, geht man so vor, dass man sich nur ein einzelnes Gasmolekül denkt, welches sich durch die ganze Population der anderen umgebenden Gasmoleküle hindurchbewegt.
Des Weiteren setzt man voraus, dass die anderen Moleküle hypothetisch in Ruhe verharren. Die Anzahl der Moleküle pro Volumeneinheit ergibt dann eine Teilchenanzahldichte n.
Man stellt sich also vor, wie sich ein einzelnes Molekül, durch diese Population hindurch bewegt. An dem Molekül angeheftet ist sein Wirkungsquerschnitt. Vielleicht bewegt es sich längs einer Wegstrecke x durch das System, welches man als Zylinder andeuten könnte. Entscheidend ist jetzt, ob dieses Molekül während seiner Bewegung mit einem anderen in Kontakt tritt. Das wird dann der Fall sein, wenn irgendein Mittelpunkt eines anderen Teilchens innerhalb des Zylindervolumens des ersten Moleküls hineintaucht bzw. sich überschneidet.
Letzten Endes betrachtet man das Volumen dieses Zylinders. Das Volumen ist nichts anderes als

λ ist die mittlere freie Weglänge des Moleküls
n ist die Teilchenanzahldichte
Daraus ergibt sich, je dichter die Teilchen liegen, desto kleiner ist die mittlere freie Weglänge. Oder aber, wenn der Stoßquerschnitt größer wird, kommt es ebenfalls eher zu einem Stoß, und die mittlere freie Weglänge verringert sich analog.
Obiger Fall gilt nur unterer der Voraussetzung, dass sich die umgebende Population in Ruhe befindet. In der Realität ist das aber nicht so, denn die Moleküle zittern alle herum. Und so kommt es zwangsläufig zu mehr Stößen, die berücksichtigt werden müssen. Insofern ändert sich die Gleichung noch etwas:
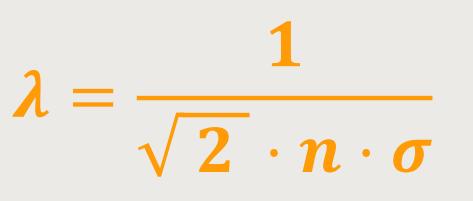
Das ist die mittlere freie Weglänge eines Moleküls in einem Gas.
Wenn man jedoch Gemische von verschiedenen Substanzen betrachtet, wird die Berechnung
etwas komplizierter. Für unsere Atmosphäre, die zu 78% aus Stickstoff(N2)
besteht, ergibt sich unter Normalbedingungen eine mittlere freie Weglänge von
Aber bei der Geschwindigkeitsverteilung geht es natürlich auch immer um die Temperatur in einem System. Wir hatten bereits in Verbindung mit der Kinetik idealer Gase den Begriff Wärmekapazität kurz behandelt. Im nächsten Kapitel wollen wir das Thema Wärmekapazität noch etwas genauer beleuchten.
⇦ Kapitel Kapitel ⇨