Man führt also in verschiedenen Prozessen eine Wärmemenge zu. Im ersten Fall hat man das Volumen konstant gehalten. Da war es so, dass nichts von der zugeführten Wärmemenge in Arbeit umgewandelt werden kann. Die gesamte Wärmemenge geht in die innere Energie.
Im zweiten Fall hat man den Druck konstant gehalten. Da ist es ein bisschen komplizierter. Ein Teil der Wärmemenge geht in die Änderung der inneren Energie und ein Teil wird wieder als Arbeitsleistung abgegeben. Damit das System aber immer im Gleichgewicht bleibt, hat man den Begriff der Enthalpie eingeführt. Auf diese Weise erhält man die Möglichkeit, die zugeführte Wärmemenge wieder nur als Änderung einer einzelnen Zustandsgröße darzustellen. Und damit kann man diese isobaren Prozesse formal genauso einfach beschreiben, wie die anderen beiden.
Im dritten Fall hat man die Temperatur konstant gehalten. Dann geht nichts von der zugeführten Wärmemenge in die innere Energie über. Sondern alles wird in die mechanische Energie umgesetzt.
Was ist aber, wenn das System thermisch isoliert ist? Also, wenn gar keine Wärmemenge zugeführt oder abgeführt werden kann? So, wie das zum Beispiel bei einer Thermosflasche der Fall ist. Man kann zwar Arbeit leisten, und es können sich auch der Druck und das Volumen ändern, aber keine Wärmemenge kann über die Systemgrenzen kommen. Das ist, was man unter einem „adiabatischen” Prozess versteht.
Auch hier legt man wieder den Ersten Hauptsatz (s.o.) zugrunde:
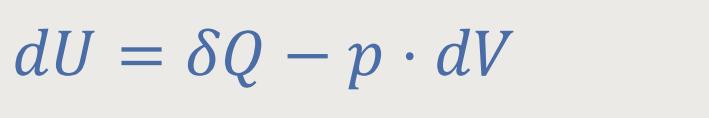
Jetzt ist aber die zugeführte Wärmemenge
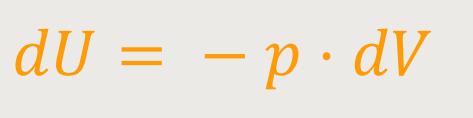
Auch hier orientiert man sich wieder an der Definition der Temperatur (s.o.):
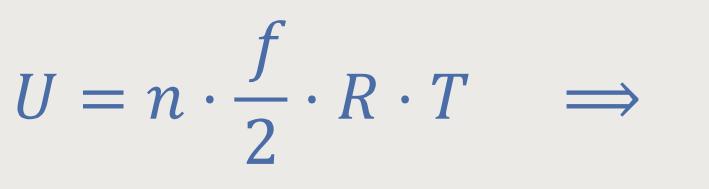
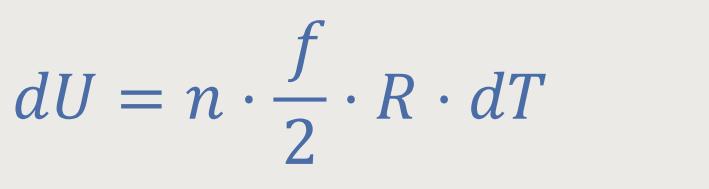
Nach Einsetzen erhält man die Differentialgleichung:
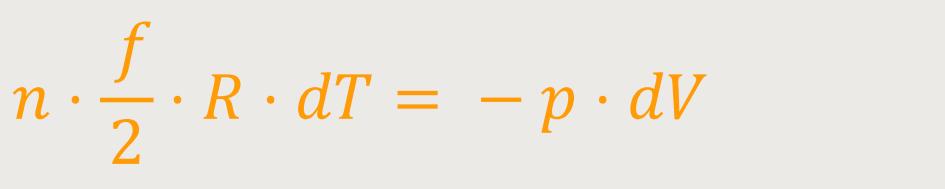
Bevor wir das noch ein bisschen Umformen, greifen wir wieder auf die Zustandsgleichung des idealen Gases zurück:
Wenn man das jetzt entsprechend in die Differentialgleichung einsetzt, erhält man:
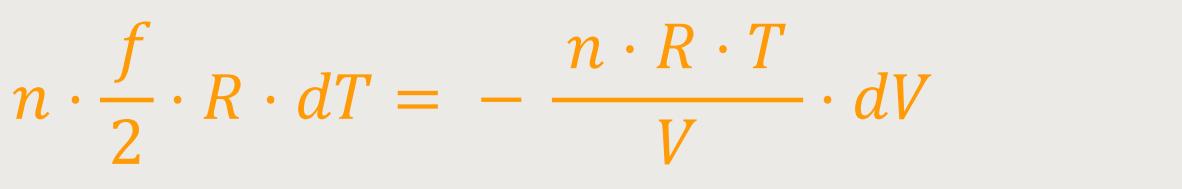
Mathematisch gesehen ist die Thermodynamik eine recht einfache Angelegenheit. Nur mit den Begriffen muss man etwas aufpassen.
Nun lässt sich n noch rauskürzen, wobei
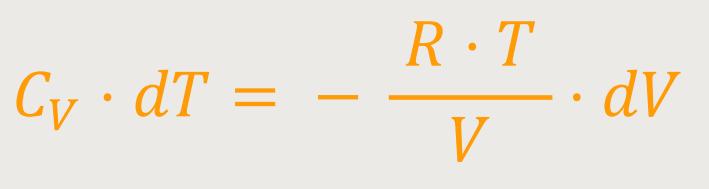
Jetzt kann man noch die Variablen trennen:
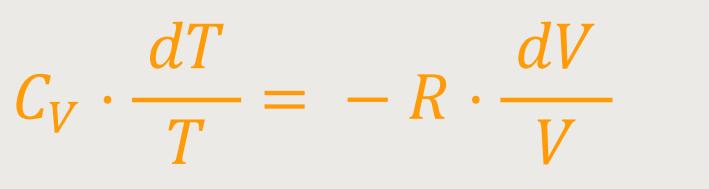
Und wenn man das entsprechend integriert, ergibt sich daraus:
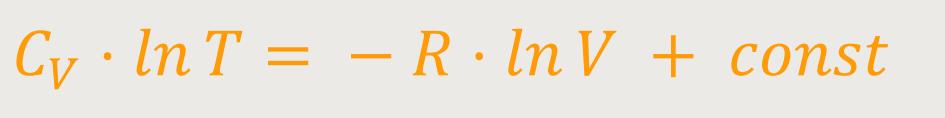
Bei solchen Integrationen kann man den Vorfaktor auch in den Exponenten schreiben und anschließend zusammenfassen:


Das bedeutet wiederum, dass nicht nur für den Logarithmus, sondern auch für die Größe selbst gilt:

Für den Exponenten R kann man auch schreiben:
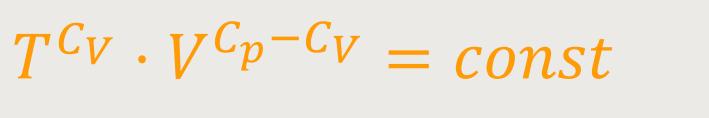
Da

Und wenn man jetzt die Zustandsgleichung idealer Gase einsetzt, erhält man:
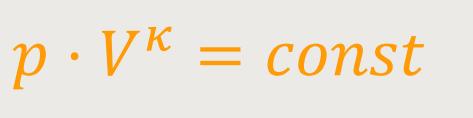
κ (kappa) ist der Adiabaten-Index (Luft: 1,4)
Also, wenn man ein isothermes System komprimiert, dann geht der Druck hinauf. Aber das
System bleibt immer auf der gleichen Temperatur, weil auch Wärme abgeführt
wird. Wenn man das System dagegen adiabatisch komprimiert, und zwar so, dass keine Wärme
verloren geht, dann verläuft die Funktion steiler, weil die innere Temperatur ansteigt.
Und das bedeutet gleichzeitig, dass der Druck anwächst. Im
Bei adiabatischen Temperaturerhöhungen, sprich bei rascher Kompression, wo die Wärmemenge keine Gelegenheit hat, schnell zu entweichen, wird es heiß und das Gasgemisch explodiert.
Bevor wir den Zweiten Hauptsatz betrachten, möchten wir eine grundsätzliche empirische Erkenntnis festhalten. Diese Erkenntnis ist so offenkundig, dass sie nicht durch Experimente belegt werden muss. Denn nicht alle Vorgänge, die laut Energieerhaltungssatz erlaubt sind, werden auch wirklich eintreffen. Das ist vor allem dann der Fall, wenn wir von großen thermodynamischen Systemen ausgehen, mit denen wir es im Allgemeinen ständig zu tun haben.
In diesem Fall erhebt sich die Frage, inwieweit gewisse Voraussetzungen, die man über die Bewegung der Moleküle in einem System oder Körper macht, zusätzliche Einschränkungen hervorrufen. Wenn man des Öfteren ein molekulares Chaos voraussetzt, so ist eine solche chaotische Bewegung in der Realität offensichtlich erfüllt.
Diese empirisch gemachten Erfahrungen kann man in zwei gleichwertigen Aussagen formulieren. Die eine Aussage stammt von Clausius, die andere von Kelvin. Beide Aussagen dienen als Ausgangspunkt für unsere weiteren Überlegungen. Wir erhalten damit eine weitere Grundlage für die Beschreibung thermodynamischer Vorgänge.
In diesem Zusammenhang tritt eine weitere empirisch eingeführte Größe auf, nämlich die „Entropie”. Diese Größe ist genauso unanschaulich wie die zuvor behandelte Größe der Enthalpie. Die Entropie ist ebenfalls eine Zustandsgröße, die eindeutig einem thermodynamischen Zustand zukommt. Egal auf welchem Weg man diesen Zustand erreicht, lässt sie sich gut berechnen.
Der Zweiter Hauptsatz der Thermodynamik lässt sich auf zweierlei Weise definieren ...
... nach Clausius:
Es gibt „keine” thermodynamische Zustandsänderung, deren „einzige” Wirkung darin besteht, eine Wärmemenge einem kälteren Wärmespeicher zu entziehen und einem wärmeren zuzuführen.
... nach Kelvin:
Es gibt „keine” thermodynamische Zustandsänderung, deren „einzige” Wirkung darin besteht, dass einem Wärmespeicher Wärme entzogen wird, und vollständig in Arbeit umgesetzt wird.
Derartige Gesetzmäßigkeiten dürfen nicht außer Acht gelassen werden, weil sie einem Prozess grundsätzliche Einschränkungen auferlegen.
Unter einem „Perpetuum mobile zweiter Art” versteht man eine periodisch
arbeitende Maschine, deren einzige Wirkung darin besteht, dass einem Wärmespeicher
Wärme entzogen wird, und diese dann vollständig in mechanische Energie
umgesetzt wird. Aus dem Zweiten Hauptsatz ergibt sich entsprechend:
Es gibt kein solches Perpetuum mobile zweiter Art.
Um die Wichtigkeit und die Bedeutung des Zweiten Hauptsatzes klar zu machen, möchten wir nochmals eine der bereits besprochenen Zustandsänderungen aufgreifen. Nämlich eine reversible, isotherme Expansion:
Wir erinnern uns kurz an einen Zylinder mit einem Kolben, in dem sich ein ideales Gas befindet, welches unter einem gewissen Druck steht. Dieser Zylinder befindet sich in einem Wärmebad, und so wird dementsprechend durch die Systemwände Wärme dem System zugeführt. Das heißt, das System bleibt letztlich außen und innen immer auf konstanter Temperatur, und somit in einem Gleichgewicht. Diesen Prozess nennt man, wie bereits behandelt, eine isotherme Zustandsänderung. Bedingt durch den steigenden Druck im Gas, wird sich der Kolben nach außen bewegen.
Der Erste Hauptsatz besagte ja:
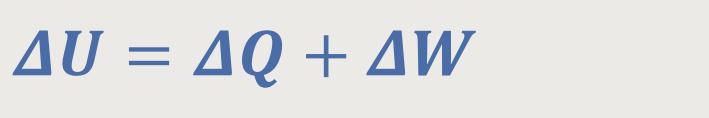
Hiernach kann eine Änderung der inneren Energie eines Systems hervorgerufen werden, indem man entweder Wärmeenergie zuführt oder mechanische Energie zuführt. Ist die jeweilige Größe mit einem negativen Vorzeichen versehen, so wird diese entsprechend von dem System abgeführt.
Wenn man aber eine reversible isotherme Expansion des Volumens hat, dann wird
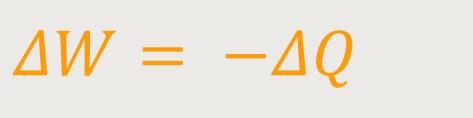
Jetzt hat man genau das, was es laut Zweitem Hauptsatz eigentlich nicht gibt. Scheinbar wird die zugeführte Wärmemenge doch vollständig in mechanische Arbeit umgesetzt.
Oder alternativ könnte man auch schreiben:
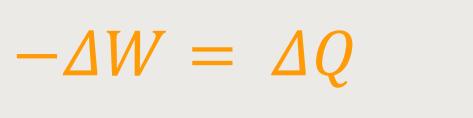
Hiernach ist die vom System abgeführte Arbeit gleich der zugeführten Wärmemenge.
Der entscheidende Punkt ist aber, dass das Volumen expandiert. Man kann hier nämlich eine zusätzliche Zustandsänderung beobachten. Und das widerspricht dem Zweiten Hauptsatz. Natürlich wäre es schön, wenn man nach einer solchen Übertragung von Wärme in verrichtete Arbeit, wieder auf den gleichen Zustand zurückkommt, und sich dieser Schritt dann periodisch wiederholt. Das wäre ja dann ein Perpetuum mobile zweiter Art: Eine periodisch arbeitende Maschine. Es heißt aber, deren „einzige Wirkung darin besteht ... .” Da wir hier aber eine zusätzliche Expansion des Systems haben, ist das nicht gegeben.
Also, die reversible isotherme Expansion überführt die zugeführte Wärme vollständig in die verrichtete Arbeit. Und das geht immer weiter und weiter. Im Grunde ist das ist ja auch der Sinn von Maschinen, dass sie periodisch arbeiten, und immer wieder die gleiche Zustände durchlaufen werden. Da man immer wieder zum gleichen Ausgangszustand zurückkehrt, hat man es mit einem sogenannten Kreisprozess zu tun.
Betrachtet man einen periodischen „Kreisprozess”, so kann man mechanische Energie in Form von Reibung vollständig in thermische Energie umsetzen. Dieser Prozess funktioniert jedoch nur in eine Richtung, denn man kann gegenläufig Wärme nicht vollständig in Arbeit umsetzen.
Es gibt aber verschiedenartige Kreisprozesse. Und so werden wir zunächst den herausgreifen, der aus grundsätzlichen Überlegungen am einfachsten zu beschreiben ist. In Erweiterung kann man dann andersartige Kreisprozesse betrachten, die mehr der Realität entsprechen. Aber diese lassen wir vorerst außen vor. Zu Beginn werden wir wieder gewisse Rahmenbedingungen festlegen, die möglichst optimale Interpretationen zulassen, quasi eine obere Grenze.
Da ist zum Beispiel der sogenannte Carnot-Kreisprozess zu nennen. Es geht darum, inwieweit lässt dieser Prozess die Möglichkeit zu, Wärme in Arbeit umzusetzen. Vielleicht geht es ja doch zu 100%.
Grundlage bildet wieder ein reversibel geführter Kreisprozess in einem idealen Gas. Reversibel heißt hier, dass man ständig durch lauter Gleichgewichtszustände geht. Natürlich muss man bedenken, dass der Wärmeaustausch in der Realität sehr langsam abläuft. Aber wir nehmen jetzt einmal an, die Wärme hat Gelegenheit ständig zuzufließen, sodass die Temperatur im System immer weitestgehend konstant ist, und man also immer lauter Gleichgewichtszustände durchläuft. Und das würde dann auch möglich machen, den Vorgang umzukehren, deshalb der Ausdruck reversibel.
Um sich einen solchen Kreisprozess vorzustellen, betrachtet man ein
Der Carnot-Prozess läuft im Grunde zwischen zwei Wärmereservoirs ab. Das eine Wärmereservoir hat die Temperatur TW (T-warm), und das andere die Temperatur TK (T-kalt). Wir werden jetzt die Prozesse nochmals schrittweise analysieren.
Der Vorteil dieses Carnot-Prozesses besteht darin, dass man nur zwei Arten von Zustandsänderungen betrachten muss, nämlich die isothermen und die adiabatischen. Aber bezogen auf den Kreisprozess sind es in Summe vier solcher Zustandsänderungen. Die Idee ist, dass man für jede dieser Zustandsänderungen ausrechnet, wie groß jeweils die Arbeit ist, die hier entweder vom System verrichtet wird oder an dem System geleistet wird. Denn wir wissen ja bereits, wenn man in einem isolierten System eine isotherme Kompression durchführen möchte, muss von außen Arbeit zuführt werden. Und das Ganze macht nur dann Sinn, wenn netto etwas übrigbleibt.
Nachdem wir diese vier Schritte nochmals analysiert haben, wird Bilanz gezogen. Das Ergebnis zeigt dann, wie hoch der Wirkungsgrad ist. Zunächst folgt eine kurze Übersicht von dem, was im Detail betrachtet werden soll.
Es wird beim ersten Schritt Wärmemenge ΔQW zugeführt, damit das System isotherm expandieren kann. Anschließend wird bei allen nachfolgenden Schritten mechanische Arbeit geleistet. Im Gegenzug muss später eine gewisse Wärme das System wieder verlassen. Was man aber insbesondere wissen möchte ist, was bleibt netto für eine Arbeit übrig, und in welchem Verhältnis steht sie zu der hineingesteckten Wärmemenge. Man kann bereits jetzt schon erkennen, dass der Wirkungsgrad nicht bei 100% liegen kann, weil ja etwas von der Wärmemenge wieder rausgeht. Dieser Anteil konnte nicht in Arbeit umgesetzt werden. Und damit ist der erste Hauptsatz der Thermodynamik nicht erfüllt und damit auch keine 100% Wirkungsgrad.
Gehen wir die Schritte jetzt nach und nach durch. Wir setzen nach wie vor ein ideales Gas voraus, sowie reversible Zustandsänderungen.
⇦ Kapitel Kapitel ⇨

