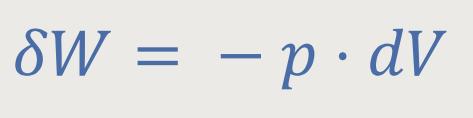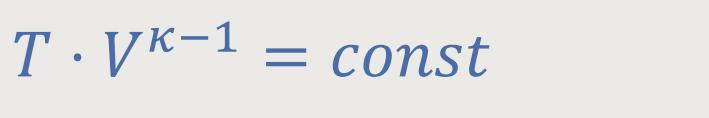Wir haben bereits im vorherigen Kapitel auf Kreisprozesse Bezug genommen. Als idealen Modellprozess, den man zwar in der Praxis nicht so leicht realisieren kann, aber dafür umso besser theoretisch beschreiben kann, verwendet man den sogenannten „Carnot-Kreisprozess”.
Die Betrachtung von Kreisprozessen ist insofern sinnvoll, weil jede thermodynamische Maschine letzten Endes nach dem Prinzip eines Kreisprozesses läuft. Es werden in periodischen Abständen immer wieder die gleichen Vorgänge durchlaufen. Und die Idee ist, dass bei einem solchen Kreisprozess Wärme zugeführt wird, die man anschließend als mechanische Arbeit gewinnen kann.
Wir gehen jetzt die bereits angesprochenen Schritte nach und nach durch. Wir setzen nach wie vor ein ideales Gas voraus, sowie reversible Zustandsänderungen.
Dieser Schritt ist eine isotherme Expansion.
Wir starten im warmen Wärmereservoir mit der Temperatur
Ein Wärmereservoir ist ein System, das groß genug ist, damit es keinen Einfluss hat, wenn eine gewisse Wärmemenge ΔQ in einen Kreisprozess eingeleitet wird. Beide Wärmereservoirs sollen weiterhin nahezu auf der gleichen Temperatur bleiben.
Und weil es ein isothermer Prozess ist, ist das
Daher ist auch das
Und das bedeutet wiederum:

Wir wissen ja, wenn man ein kleines Volumen ändert, erhält man:
Und wenn man eine nennenswerte Strecke zwischen den Punkten 1 und 2 zurücklegt, muss integriert werden, und daher ergibt sich:
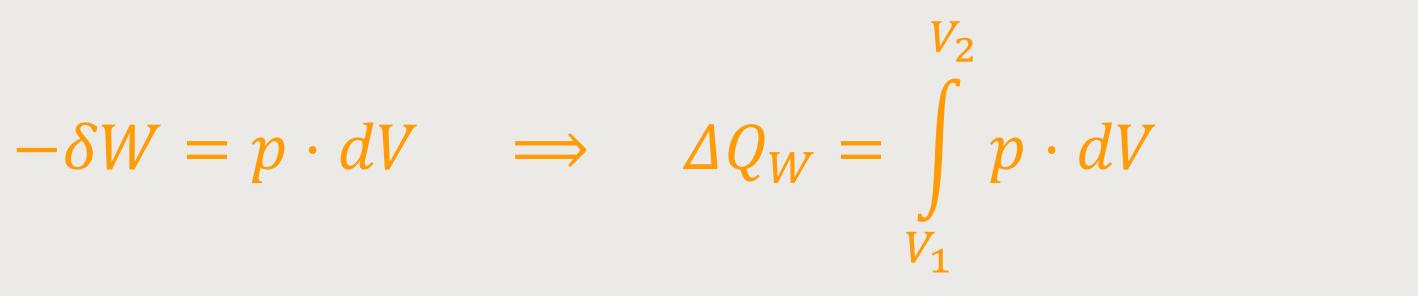
Unter Verwendung der Zustandsgleichung idealer Gase erhält man durch Einsetzen und anschließendes Umformen:
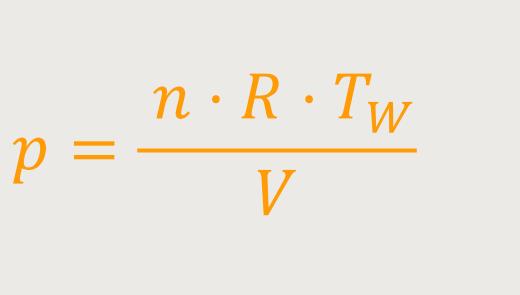
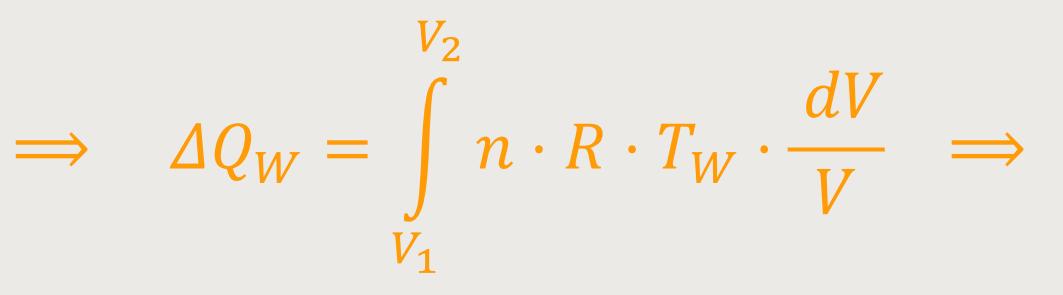
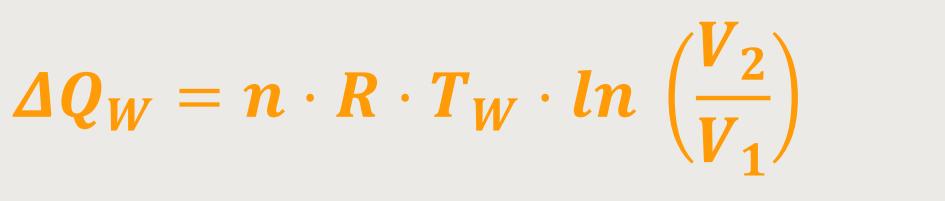
Das heißt, für die Wärmemenge gilt
Dieser Schritt ist eine adiabatische Expansion.
Und weil es ein adiabatischer Prozess ist, ist das
Es handelt sich ja um ein thermisch isoliertes System. Und dann verbleibt nur mehr vom Ersten Hauptsatz:

Dadurch erhält man eine Änderung der inneren Energie. Und daher ergibt sich für die Arbeit:
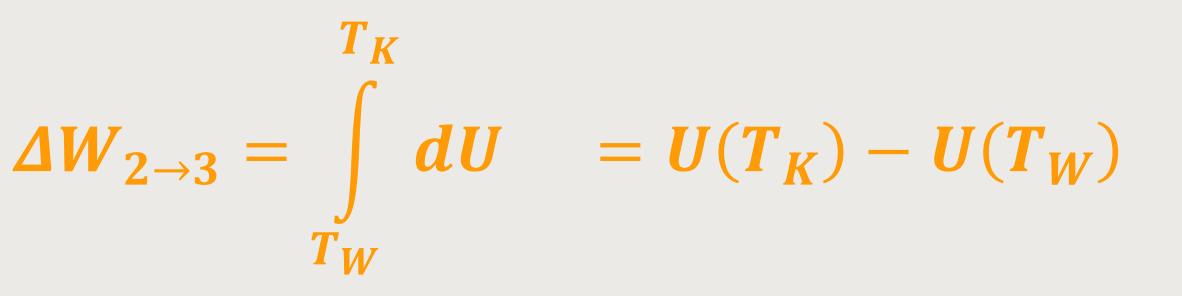
Da die innere Energie proportional zur Temperatur ist, wird die Differenz aus
Dieser Schritt ist eine isotherme Kompression.
Und weil es ein isothermer Prozess ist, ist das
Daher ist auch
Und das bedeutet wiederum, dass:

Auch hier integriert man wieder entsprechend obiger Vorgehensweise:

Unter Verwendung der Zustandsgleichung idealer Gase erhalten man durch Einsetzen und anschließendes Umformen:
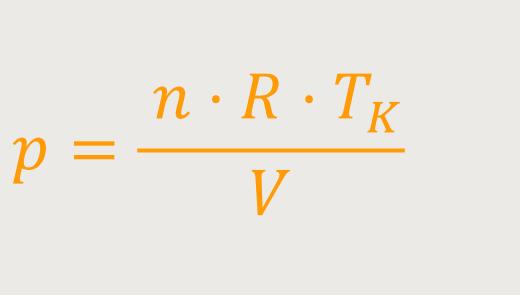
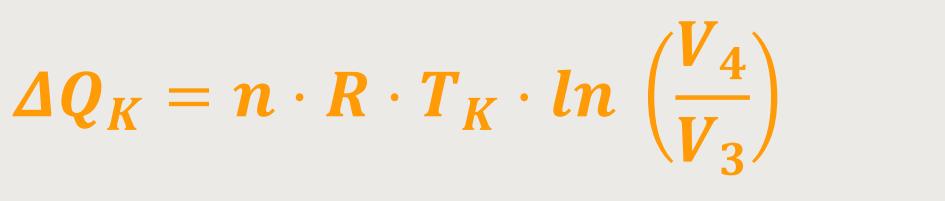
Das heißt, für die Wärmemenge gilt
Dieser Schritt ist eine adiabatische Kompression.
Damit kommt man von der kalten Temperatur wieder auf die warme Temperatur.
Und weil es ein adiabatischer Prozess ist, ist das
Das bedeutet, wie bereits oben beschrieben:

Und in dem Fall lässt sich das analog zu oben ausrechnen:
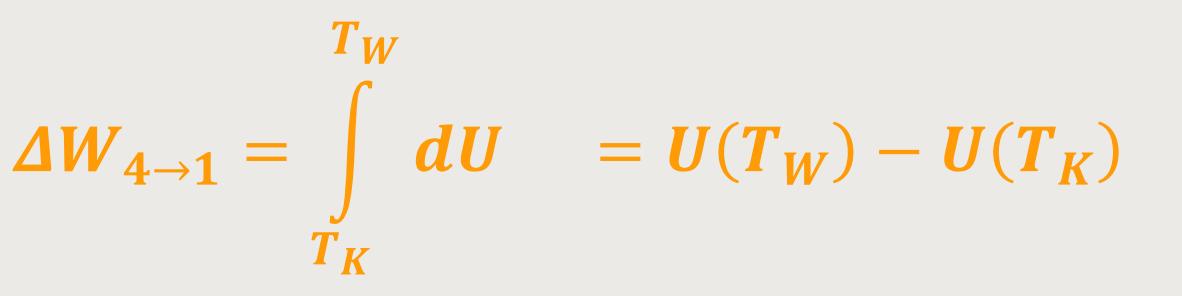
Schauen wir uns an dieser Stelle nochmals die beiden adiabatischen Schritte an. Das heißt, die adiabatische Expansion und die adiabatische Kompression.
Man erkennt deutlich, was zunächst als Arbeit vom System geleistet wurde, muss später in gleicher Weise dem System wieder zurückgeführt werden. Diese zwei Schritte sind zwar notwendig, um von der einen zur anderen Temperatur zu gelangen, und damit auch den Kreisprozess zu gewährleisten. Sie haben aber keinen Einfluss auf die geleistete Arbeit.
Letztlich geht es nur um die zwei isothermen Schritte. Hier kann man davon ausgehen, dass die Bilanz positiver ausfällt. Also, um die adiabatischen Schritte brauchen wir uns in weiterer Folge nicht mehr zu kümmern. Sie liefern arbeitsmäßig in Summe nichts. Es geht nur mehr darum, die zwei verbleibenden isothermen Schritte zu interpretieren.
Dennoch ist ein abschließender Vergleich der beiden adiabatischen Schritte
notwendig. Denn es wäre natürlich wichtig zu wissen, wie hängt denn
Wir haben bereits festgestellt, dass bei den adiabatischen Prozessen die Zustandsänderungen wie folgt definiert wurden:
κ (kappa) ist der Adiabaten-Index
Unter der Voraussetzung, dass die Zustandsänderung längs eines adiabatischen Prozesses konstant sein muss, gelten also für die beiden adiabatischen Prozesse:
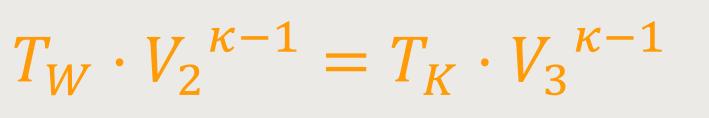
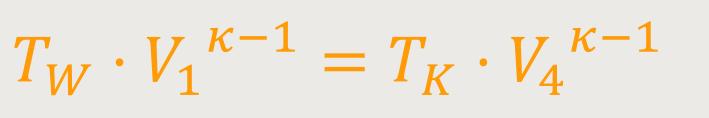
Wenn man beide Beziehungen abschließend miteinander dividiert erhält man:
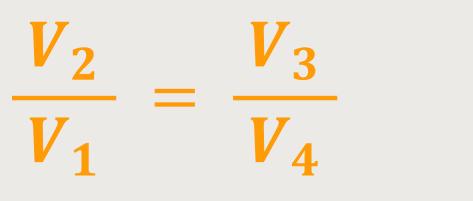
Damit kann man jetzt sofort die entsprechende Bilanz ermitteln.
Die gesamte geleistete Arbeit stellt sich wie folgt dar:
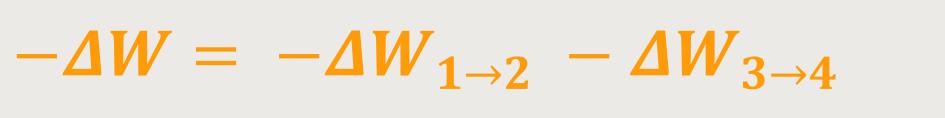
Unter Berücksichtigung, dass ...
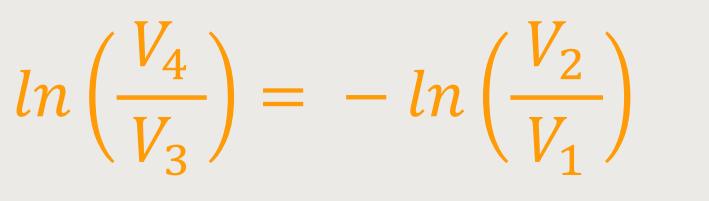
... erhält man entsprechend durch Einsetzen:
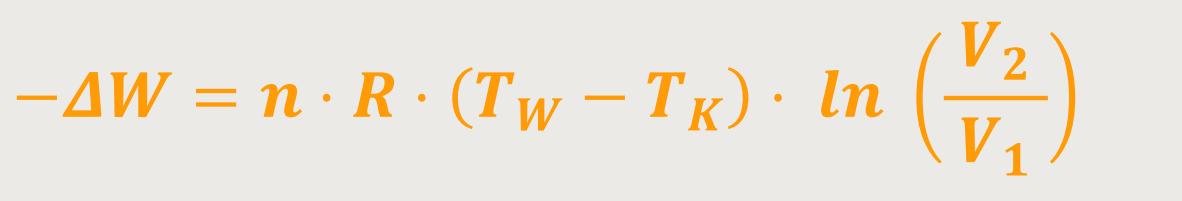
Das heißt, für die Arbeit gilt
Dem gegenüber schauen wir uns nochmals die Wärmemengen an:
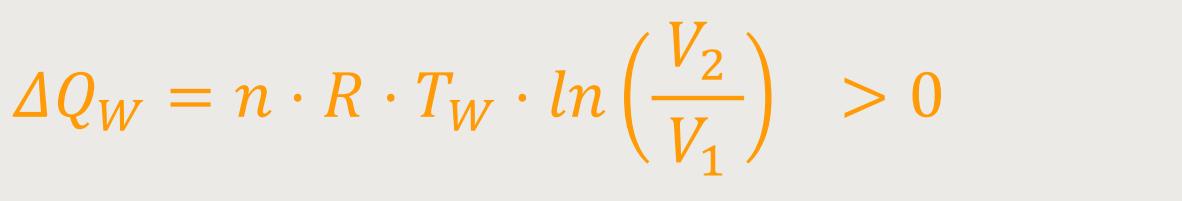
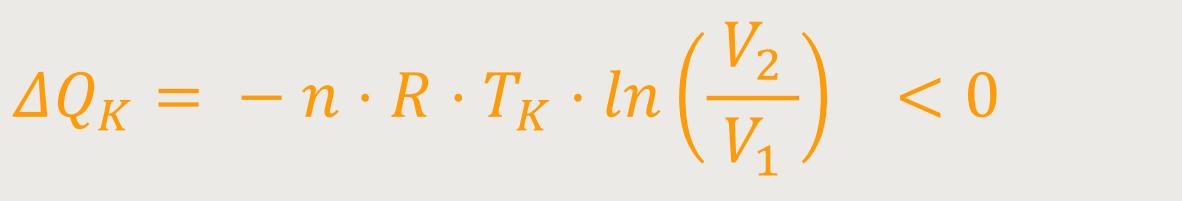
Nachdem wir alle entscheidenden Bilanzen gezogen haben, werden abschließend die letzten beiden Beziehungen aufsummiert.
Damit erhält man letzten Endes den Zweiten Hauptsatz:
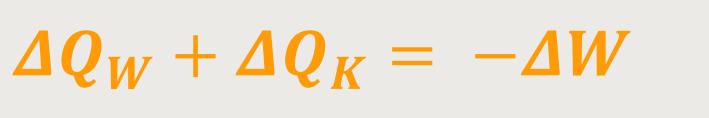
Das, was an Wärme zugeführt und später als Wärme wieder abgeführt wurde, ergibt das, was letztlich an Arbeit geleistet wird. Damit bestätigt sich, dass der Erste Hauptsatz hier erfüllt ist.
Aber noch wichtiger ist der Wirkungsgrad, der in der thermodynamischen Literatur meistens wie folgt bezeichnet wird:
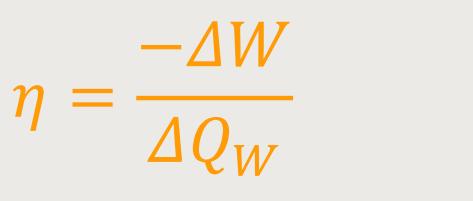
− ΔW ist die abgeführte Arbeit
ΔQW ist die zugeführte Wärmemenge
Und das ist nichts anderes als die mechanische Arbeit, die vom System in Summe verrichtet
wurde, dividiert durch die Wärmemenge, die hinein gesteckt werden muss. Leider geht
natürlich auf der anderen Seite eine Wärmemenge
Letztlich stellt sich der Wirkungsgrad des Carnot-Prozesses wie folgt dar:
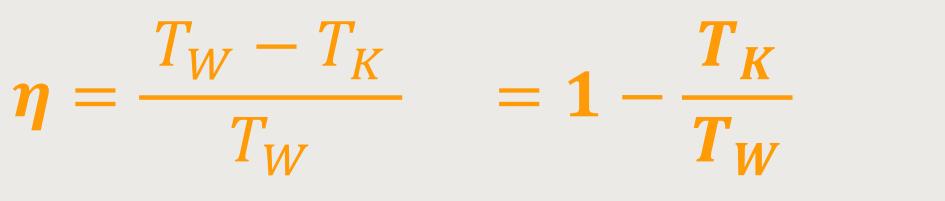
Dementsprechend hat man einen Wirkungs

Man kann also folgenden Schluss ziehen: Einerseits ist es zwar in periodischen
Kreisprozessen möglich, Arbeit komplett in Wärme überzuführen,
aber es lässt sich nicht Wärme zu 100% in Arbeit umsetzen.
Das ergibt sich aus dem Wirkungs
Wir haben gesehen, dass sehr wohl bei gewissen thermodynamischen Vorgängen 100% der hineingesteckten Wärmemenge in Arbeit umgesetzt werden kann. Das funktioniert zum Beispiel bei einem idealen Gas in einem Zylinder. Wird das System aufgeheizt, dehnt sich das Gas aus und der Kolben bewegt sich. Allerdings würde dabei nur in eine Richtung Arbeit geleistet, und das macht auf Dauer keinen Sinn. Ziel ist es, nicht nur in eine Richtung eine Bewegung zu erreichen, sondern dass der Kolben auch wieder zurückkommt.
Schließlich soll eine periodisch arbeitende Vorrichtung realisiert werden. Und da gibt es leider die Einschränkung, dass nicht alles, was man an Wärmemenge hineinsteckt, auch als Arbeit wieder herauskommt. Das wäre genau das, was man in Verbindung mit den Grundlagen der Thermodynamik als Perpetuum mobile der „zweiten” Art bezeichnet. Zur Erinnerung, das Perpetuum mobile der „ersten” Art wäre, man steckt gar keine Energie rein und es arbeitet für einen.
Bei dem der zweiten Art will man zumindest alles, was man hineinsteckt auch wieder als Arbeit herausbekommen. Aber selbst das ist nicht möglich. Denn einer der Formulierungen des Zweiten Hauptsatzes besagt, dass man keine periodisch arbeitende Maschine konstruieren kann, die nichts anderes macht, als Wärmeenergie vollständig in mechanische Energie umzusetzen. Leider wird immer wieder eine gewisse Wärme woanders abgegeben, und geht damit dem System verloren. Um das nachzuvollziehen, betrachtet man obigen Carnot-Prozess.
Eingangs haben wir die einzelnen Schritte dieses Prozesses genau analysiert und in einem Beispiel durchgerechnet. Wir haben die zugeführten und abgeführten Wärmemengen betrachtet und die Arbeiten, die dabei geleistet werden. Abschließend werden wir bereits gezogene Bilanz noch etwas beleuchten, um eine weitere Interpretation herauszuarbeiten.
Um ein besseres Verständnis der Abläufe zu erhalten, werden wir den Begriff der „Entropie” einführen. Das ist ein Begriff, der erfahrungsgemäß größere Schwierigkeiten macht. Der Begriff lässt sich nicht so anschaulich erklären, wie die Kraft, der Druck oder die Temperatur. Mit den meisten physikalischen Größen können wir etwas anfangen, weil wir sie aus dem Alltag kennen. Obwohl die Entropie ebenfalls den Alltag sehr intensiv beherrscht, haben wir keinen unmittelbaren Bezug zu dieser Größe.
Dennoch ist diese Größe auch eine Zustandsgröße, die in ihren Eigenschaften, wie verschiedene andere auch, objektiv einem Zustand zukommt, egal wie man diesen Zustand erreicht hat. Zustandsgrößen werden durch den Druck, die Temperatur oder das Volumen charakterisiert, aber ebenso auch durch die Entropie. Die Wärme war ja, wie wir wissen, keine solche Zustandsgröße.
Wie wir weiter oben gesehen haben, beträgt die Bilanz für die gesamte verrichtete Arbeit während eines Zyklus:
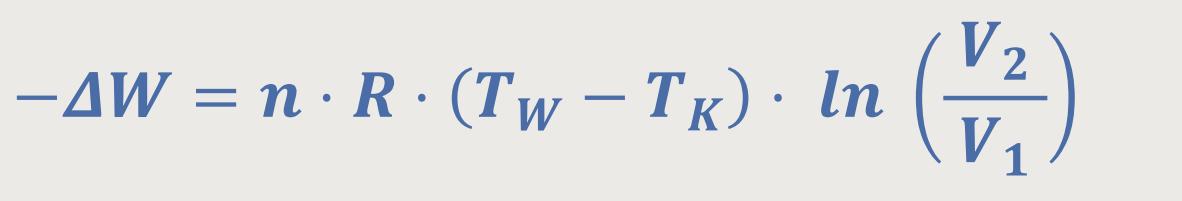
Dieses TK ist typischerweise die Temperatur der umgebenden Luft eines Kühlkreislaufes. Deshalb hat jedes Auto einen Kühler. Der Kühler entspricht dem kalten Wärmereservoir, an das die Wärme abgegeben wird.
Und das TW ist die Temperatur, die als Wärmemenge dem System zugeführt wird. Bei einer Dampfmaschine wäre das die Temperatur des Kessels. Oder beim Verbrennungs-Motor entspricht das der Phase, wo der Treibstoff zündet.
Die Wärmemengen wurden definiert als:
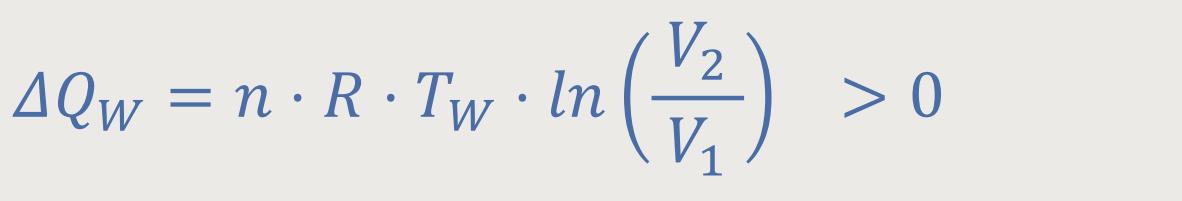
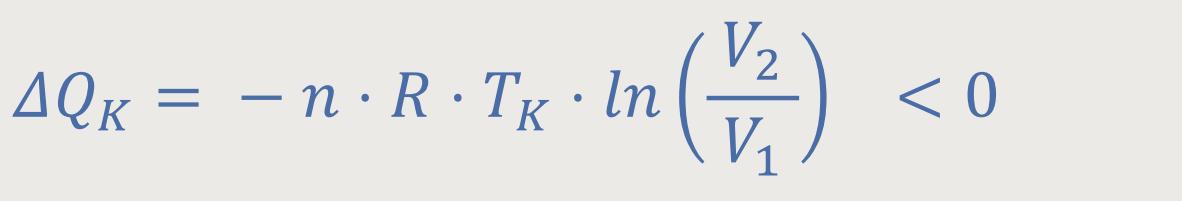
Die erste wichtige Schlussfolgerung, die daraus gezogen wurde, war der Wirkungsgrad:
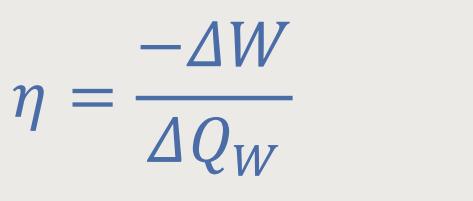
Letztlich erhält man nach Einsetzten und Wegkürzen den Wirkungsgrad des Carnot-Prozesses:
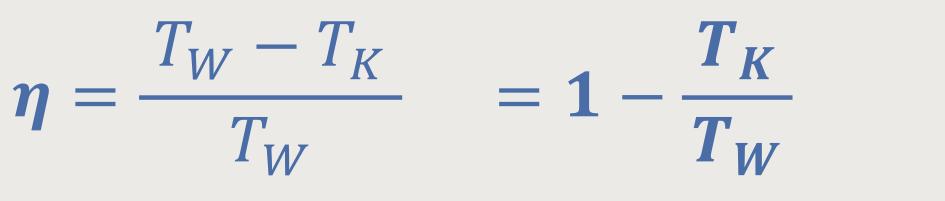
Dieser Wirkungsgrad besagt einerseits, dass man die zugeführte Wärmemenge nicht komplett als Arbeit umsetzen kann. Andererseits erhebt sich natürlich die Frage, ob man nicht vielleicht eine ähnliche thermodynamische Maschine realisieren kann, die einen besseren Wirkungsgrad hat? Der „Carnot-Satz” besagt allerdings, dass es keinen höheren Wirkungsgrad gibt. Wie lässt sich das begründen?
Es gibt in der Thermodynamik bei derartigen Fragestellungen oft die Möglichkeit, mit einer indirekten Schlussfolgerung vorzugehen. Um das zu verstehen, sind keine speziellen Formeln notwendig. Hierzu stellt man folgende Überlegungen an:
Bei obigem Carnot-Prozess wurden die einzelnen Schritte im Uhrzeigersinn durchlaufen. Des Weiteren wurde festgelegt, dass dies ein reversibler Prozess ist. Zusätzlich läuft der Prozess relativ langsam ab, sodass man in guter Näherung davon ausgehen kann, dass sich das System zu jedem Zeitpunkt annähernd in einem Gleichgewichtszustand befindet. Also könnte man den Prozess auch umdrehen und in Gegenrichtung durchlaufen lassen. Was würde bei diesem Gedankenspiel mit dem Prozess geschehen?
In diesem Fall müsste man dem System zunächst eine Gesamtarbeit zuführen. Man könnte quasi sagen, wir kurbeln an dem Carnot-Prozess. Als Ergebnis wird die Wärme dann das System in der Gegenrichtung durchlaufen. Das heißt, es wird dem kälteren Wärmespeicher Wärme entnommen und damit dem wärmeren Speicher zusätzliche Wärme zugeführt.
Dieses Funktionsprinzip kennt man von der Wärmepumpe. Das ist im Grunde nur ein gegenläufiger Kreisprozess. Und wenn man jetzt wie oben dazu übergeht, das System aufzuheizen, benötigt man einen sehr großen Wärmespeicher, zum Beispiel aus dem Erdinneren.
Anschließend betreibt man mit einem Elektromotor eine Wärmepumpe. Dazu wird natürlich Arbeit verrichtet, aber die Wärme wird dadurch auch hinaufgepumpt. Schließlich kann man bei einer höheren Temperatur TW eine entsprechende Wärme abgeben. Und das führt dann zu den energieeffizienten Wärmepumpen, die sich für ein ökonomisches Heizen immer mehr durchsetzen.
Jetzt könnte man hergehen, und sagen: Nehmen wir an, es gäbe eine Maschine, die einen höheren Wirkungsgrad hat, als der Carnot-Prozess. Dann würde einerseits die bisherige Carnot-Maschine als Wärmepumpe zwischen den beiden Wärmereservoirs eingesetzt. Diese Wärmepumpe wird dann ihrerseits betrieben von dem anderen Prozess, der einen höheren Wirkungsgrad hat. Was wird dann in Summe passieren, wenn diese beiden quasi wie ein Zwillingsgespann betrieben werden?
In diesem Fall würde die Wärme vom kälteren zum wärmeren Reservoir überführt werden. Und genau das widerspricht der Aussage von Clausius. Niemals wird eine Wärmemenge freiwillig und ohne irgendwelche anderen Einflüsse on einem kälteren zu einem wärmeren Reservoir hinüberwechseln. Und aus dieser logischen Schlussfolgerung heraus, wird es keine Maschine geben, die einen besseren Wirkungsgrad hat, als die Carnot-Maschine.
Daher besagt der Carnot-Satz:
Es gibt keine Maschine, die einen höheren Wirkungsgrad hat.
Hätte man dann nämlich einen Wirkungsgrad
Man kann also als wesentlichen Punkt festhalten:
Es kann bei periodischen Vorgängen sehr wohl mechanische Arbeit vollständig in Wärme umgesetzt werden. Aber umgekehrt kann Wärme nicht vollständig in Arbeit umgesetzt werden. Aufgrund des Wirkungsgrades lässt sich diese Schlussfolgerung ziehen. Das ist ein ganz wesentlicher Umstand in der Thermodynamik, dass es zwar in der einen Richtung geht, aber in der anderen eben nicht. Wir wollen noch kurz eine andere Feststellung betrachten.
Während des Kreisprozesses wird eine gewisse Wärmemenge ΔQW zugeführt, und im weiteren Verlauf eine andere Wärmemenge −ΔQW wieder abgeführt. Wenn man eine Wärmebilanz durchführt, erhält man als Ergebnis eine Differenz. Man hat zwar nach einem Zyklus wieder den gleichen Ausgangszustand erreicht, mit dem gleichem Druck, der gleichen Temperatur und dem gleichen Volumen. Aber dennoch hat man mehr Wärme hineinsteckt, als man wieder herausbekommt.
Daraus lässt sich ebenfalls erkennen, dass die Wärmemenge keine Zustandsgröße sein kann. Denn wenn sie eine Zustandsgröße wäre, müsste diese Wärmemenge dem Ausgangspunkt objektiv zukommen. Damit gilt für die Wärmemenge nach Durchlaufen eines Zyklus:

Beide Größen kompensieren sich nicht. Denn wenn sich diese beiden ΔQ immer kompensieren würden, könnte der Prozess nie eine Arbeit leisten.
Wenn man diese beiden erarbeiteten Gleichungen ...
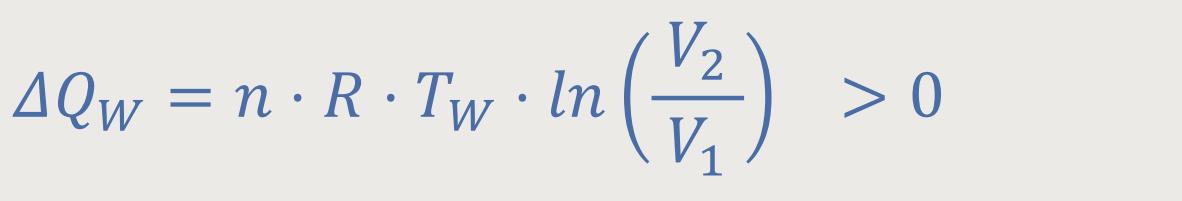
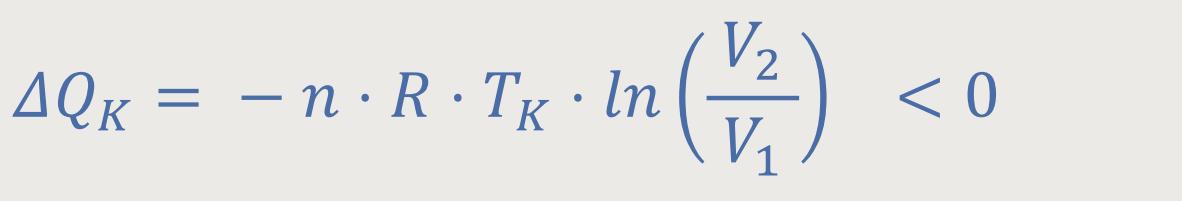
... miteinander addiert, kann man auch etwas Weiteres erkennen:
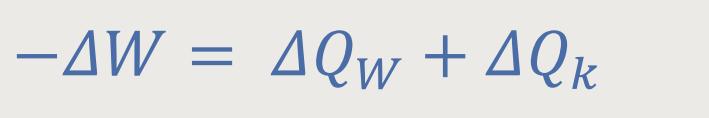
Das entspricht auch dem Energieerhaltungssatz und nach Umformung erhält man:
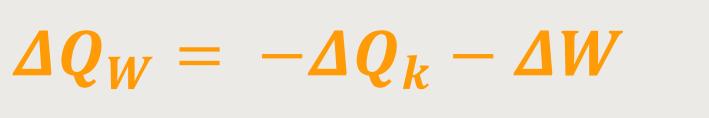
ΔQW ist die zugeführte Wärme
−ΔQK ist die abgeführte Wärme
−ΔW ist die geleistete Arbeit
Man kann bei der Carnot-Maschine ganz offensichtlich einen Wärmestrom erkennen. Da wird etwas vom heißen Reservoir zugeführt, durchläuft das System, und anschließend strömt die Wärme weiter in das kältere Reservoir. Es sind aber nicht die gleichen Beträge, denn es wird immer ein bisschen abgezweigt, und das ist die geleistete Arbeit. Auf diesem Prinzip basieren die Verbrennungsmotoren.
Langsam aber sicher kommen wir auch dem Begriff der Entropie immer näher.
Wir hatten ja aus dem Carnot-Prozess die Folgerungen gezogen:
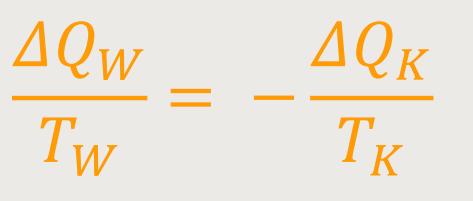
Durch diese Umformung, indem man durch die Temperatur dividiert, kann man die Wärmemengen quasi auf eine gleiche Größe bringen. So etwas nennt man auch die reduzierten Wärmemengen.
Oder man kann auch schreiben:
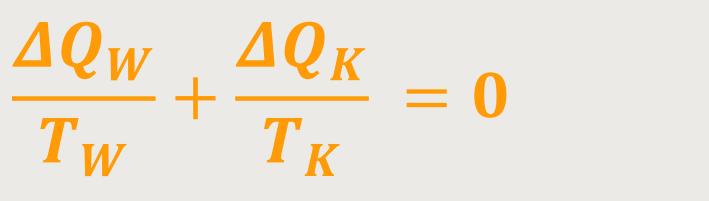
Dadurch erhält man jetzt eine Größe, die sich rund um den ganzen Kreisprozess wieder kompensiert. Die Wärmemengen haben das nicht geschafft, aber mit diesen Größen geht das. Das ist der eigentliche Gedanke, der dann zur Entropie führt, als einer praktisch verwertbaren Größe, die in dieser ganzen Wärmeproblematik wieder als Zustandsgröße geeignet ist. Die reduzierten Wärmemengen können sich nämlich nach einem Zyklus kompensieren, sodass wieder Null rauskommt.
Wie sieht es denn bei beliebigen Kreisprozessen aus? Hier gilt dann ebenso, dass die Summe:
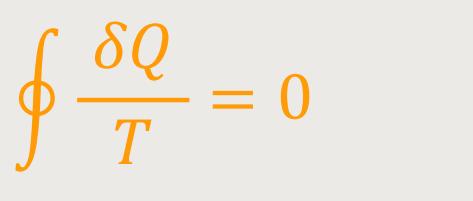
Das ist der berühmte Satz von Clausius.
Und Clausius war es auch, der ursprünglich den Begriff der „Entropie” geprägt hat.
Allerdings gilt das Ganze nur, wenn man reversible Prozesse betrachtet. Und das bedeutet,
dass die Summe über einen geschlossenen Weg im
Jetzt geht es um ein Ringintegral, bei dem es egal ist, längs welcher Richtung man das Integral durchläuft. Man kommt letztlich immer auf den gleichen Wert. Also folgt daraus, dass obiges Integral wegunabhängig ist. So war es auch bei den konservativen Kräften.
Wenn aber dieses Integral wegunabhängig ist, dann lässt sich wie bei der konservativen Kraft vorgehen, indem man ein Potential einführt. Bei den Kräften war es die „potentielle Energie”. Und was dort die potentielle Energie ist, dass ist hier die „Entropie”. Wegen dieser Wegunabhängigkeit führen wir also ein Potential ein, und definieren uns im nächsten Kapitel die Entropie.
⇦ Kapitel Kapitel ⇨