Die Thermodynamik ist ein wichtiger Teil der Physik. Sie ermöglicht es, nicht nur Gase, sondern auch beliebige Körper in einer sehr grundlegenden Weise zu beschreiben.
Wir erinnern uns, dass sich zunächst einmal das betrachtete ideale Gas bei geschlossenem Ventil nur in dem Volumen V₁ befindet, und dort eine bestimmte Temperatur hat. Das Gas breitet sich grundsätzlich über das ganze Volumen aus. Die Moleküle können ungehindert durch das Ventil strömen und verändern dadurch ihre innere Energie nicht. Da sich die mittlere Energie nicht ändert, bleibt auch die Temperatur konstant. Wir erhalten damit letzten Endes einen Zustand, bei dem das Gas expandiert, von Volumen V₁ auf das Gesamtvolumen V, sich die Temperatur dabei aber nicht ändert.
Die isotherme Expansion beim ersten Schritt des Carnot-Kreisprozesses machte es erforderlich, eine Wärmemenge zuzuführen. Weil dieses System bei der isothermen Expansion auch eine Arbeit verrichten soll. Beim Jouleschen Expansionsversuch wird aber keine Arbeit verrichtet. Denn da bewegt sich ja nichts nach außen. Der Unterschied liegt in der Reversibilität und Irreversibilität. Es wurde die Irreversibilität so definiert, dass Änderungen der Reihenfolge der äußeren Bedingungen dazu führen, dass sich auch der Vorgang umdreht. Das ist beim hin- und herschieben eines Kolbens nachvollziehbar. Das Gas expandiert entsprechend und komprimiert wieder.
Diese isotherme Expansion und die sich daraus ergebende Wärmezufuhr wurden in den vorherigen Kapiteln mehrfach herausgestellt:
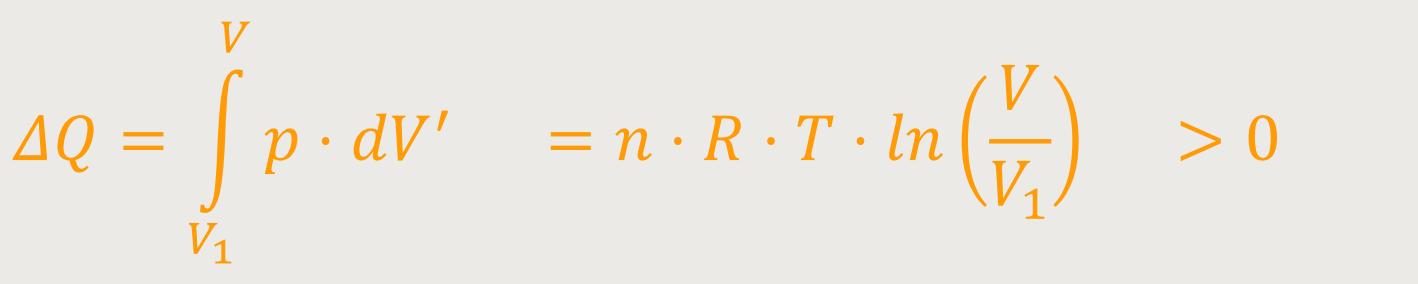
Von solchen irreversiblen Prozessen sind wir ständig umgeben. So wie die Reibungskräfte und die konservativen Kräfte auch gang und gäbe sind. Hierbei muss man nur an die Gravitation rund um die Sonne denken. Dieses Kraftfeld ist in höchstem Maße ein konservatives Kraftfeld, sonst wäre unsere Erde nach vielen Milliarden Umkreisungen schon längst in die Sonne gefallen. Dieser Grad an Konservativität des Gravitationsfeldes in der Umgebung der Sonne und die Abwesenheit irgendwelcher Reibungseffekte, haben erst Leben auf der Erde ermöglicht. Wir können hierbei von einem außergewöhnlich stabilen System sprechen.
Wie kann man dem Thema Entropie einen Sinn bzw. eine physikalische Interpretation geben? Ludwig Boltzmann hat hier ganz entscheidende Beiträge geleistet.
Die bisher betrachteten Aussagen muss man jetzt irgendwie verstehen, und auch versuchen sie statistisch zu interpretieren. Es zeigt sich, dass der Weg zum Verständnis dieser Aussagen im Wesentlichen über die Statistik führt. Hierzu macht man wieder einen Schwenk, von der phänomenologischen Thermodynamik mit ihren Hauptsätzen, den Zustandsgrößen und deren Änderungen, zurück zur Statistik. Also zu dem, was wirklich in dem System abläuft.
Was bisher betrachtet wurde, sind Aussagen über statistische Mittelwerte. Wenn man von Temperaturen spricht, von Entropien oder von Wärmezufuhren, dann spricht man eigentlich immer über Mittelwerte von Energien und Impulsen, sprich über viele, viele Moleküle in einem System.
Wenn man das zuvor Betrachtete einigermaßen nachvollziehen will, muss man sich dessen bewusst sein, dass man es mit einem System sehr vieler Moleküle und dessen Dynamik zu tun hat. Um das explizit zu untersuchen, muss man das Thema statistisch betrachten. Ziel ist es, dass vor allem dieser Begriff der Entropie physikalisch anschaulicher wird. Und da beginnen wir wieder mit dem Jouleschen Expansionsversuch. Jetzt allerdings wollen wir den gleichen Versuch statistisch betrachten.
Hierbei denken wir wieder an den Zylinder, diesmal mit schon geöffnetem Ventil. Das
Gas mit der Temperatur T hat sich bereits über das gesamte
Volumen
Mit W wird die Wahrscheinlichkeit für das Volumen V bezeichnet. Und zwar mit welcher Wahrscheinlichkeit sich das Molekül im Volumen V befindet bzw. im Volumen V₁. Die Moleküle können sich frei in beiden Kammern bewegen. Die statistische Interpretation ist im Grunde etwas ganz Einfaches.
In unserem Gedankenspiel gehen wir einmal davon aus, dass sich im Zylinder nur ein Molekül befindet. In dem Fall ist die Wahrscheinlichkeit:
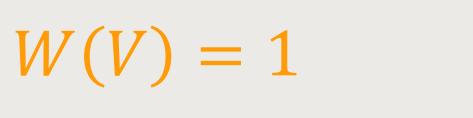
Die Wahrscheinlichkeit für das Volumen V₁ ist entsprechend:
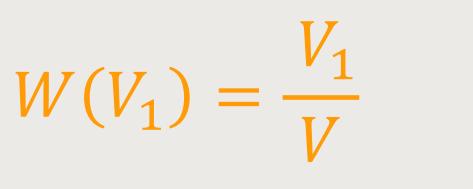
Man geht davon aus, dass sich das Molekül statisch chaotisch in dem Volumen bewegt, und weder Ort noch Geschwindigkeit zueinander korreliert sind. Man setzt quasi das molekulare Chaos voraus.
Was ist aber bei zwei Molekülen? In diesem Zusammenhang muss man sich das Prinzip der Und-Wahrscheinlichkeit klarmachen. Die Wahrscheinlichkeit, dass beide Moleküle im Volumen V sind, ist nach wie vor:
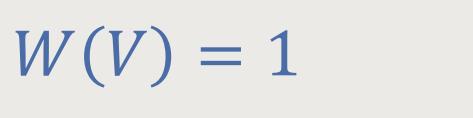
Aber, dass jetzt beide Moleküle im Volumen V₁ sind, bedeutet:
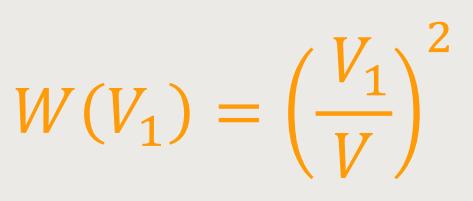
Dass zwei Dinge zur gleichen Zeit passieren, ist dann das Produkt der Wahrscheinlichkeit. Die eine Wahrscheinlichkeit multipliziert mit der anderen Wahrscheinlichkeit.
Was ist aber, wenn das System N Moleküle hat? Also so viel
Moleküle, wie zum Beispiel in
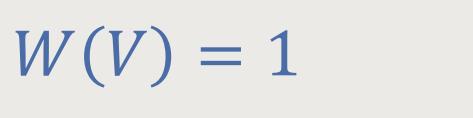
Dass sich jetzt alle Moleküle im Volumen V₁ befinden, bedeutet:
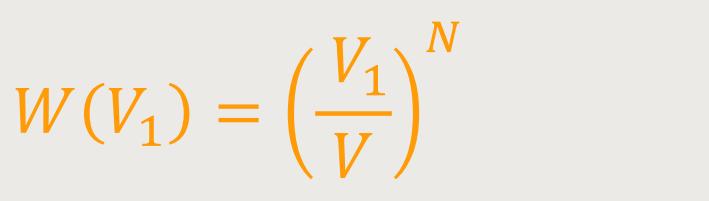
Und wenn man beispielsweise annimmt, dass
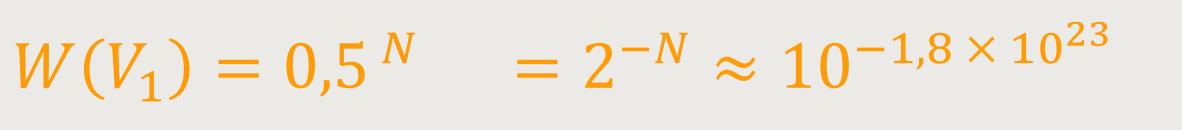
Die Wahrscheinlichkeit ist so gering, dass sich alle Moleküle nur im Volumen V₁ befinden, dass dieser Zustand praktisch nie eintreffen wird.
Jetzt könnte man denken, so eine Zahl kann man gedanklich nicht wirklich erfassen. Boltzmann hatte sich davon jedoch nicht abschrecken lassen. Er versuchte, trotz dieser monströs kleinen Zahl, eine statistische Interpretation zu machen. Und wie so oft, machte auch er einen Ansatz für die Entropie:
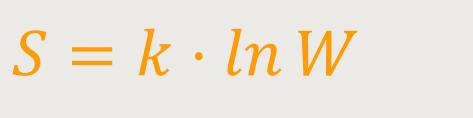
k ist die Boltzmann-Konstante
W ist die Wahrscheinlichkeit
In Verbindung mit der Temperaturdefinition wurde die Boltzmann-Konstante
bereits beschrieben, als die mittlere kinetische Energie eines Moleküls pro
Freiheitsgrad, also
Dieses


Jetzt lässt sich noch der Entropiezuwachs ΔS berechnen.
Also, die Änderung der Entropie zwischen dem Zustand, in welchem sich das gesamte
System im Volumen V₁ befindet und dem Zustand, in welchem es sich
in
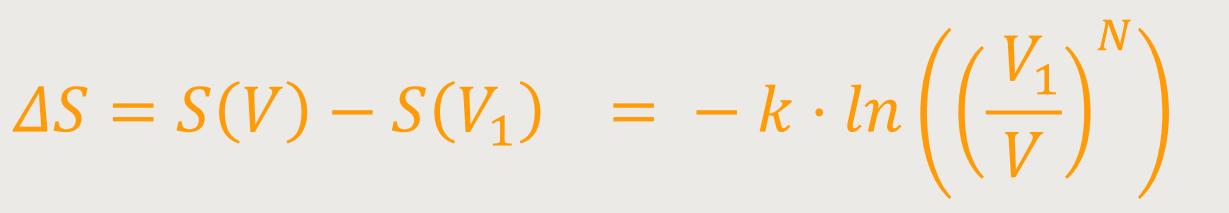
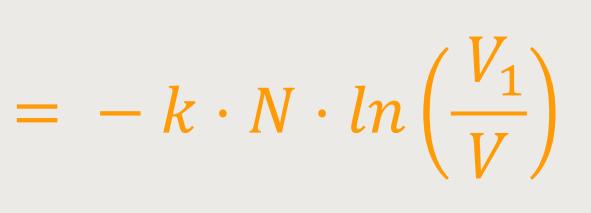
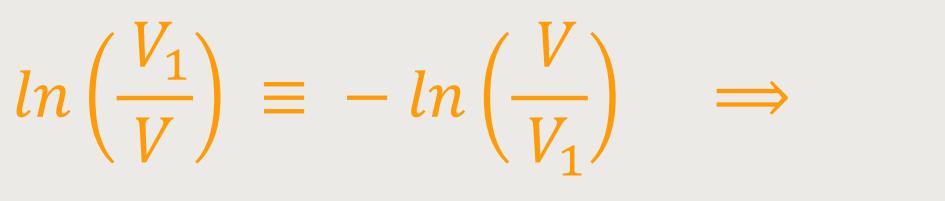
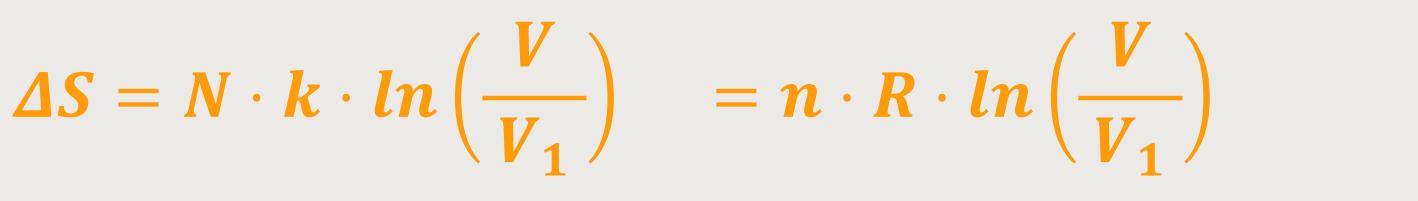
Diese statistische Überlegung führt zu einer Übereinstimmung mit den damals schon wohlbekannten phänomenologisch thermodynamischen Relationen, mit denen seinerzeit die Entropie eingeführt wurde. Jetzt auf einmal erhält das Ganze eine Interpretation. Nämlich, dass die Entropie etwas zu tun hat mit der Wahrscheinlichkeit für das Auftreten eines Zustandes.
Diese Interpretation lässt sich noch etwas konkretisieren. Bis jetzt sind wir
davon ausgegangen, dass es um eine Wahrscheinlichkeit W
geht, zwischen
Diese Thermodynamische Wahrscheinlichkeit ist nicht eine Wahrscheinlichkeit im streng mathematischen Sinne, sondern eine Wahrscheinlichkeit multipliziert mit einer konstanten Zahl. Man sagt auch, die Thermodynamische Wahrscheinlichkeit ist die Anzahl der mikroskopischen Realisierungsmöglichkeiten eines Makrozustandes. Diese Anzahl kann sehr hoch sein.
Doch wenn man das Postulat der gleichen Apriori Wahrscheinlichkeit annimmt, dann wird jede dieser einzelnen mikroskopischen Realisierungsmöglichkeiten, bei einem Makrozustand gleich wahrscheinlich auftreten. Das bedeutet, je größer diese Thermodynamische Wahrscheinlichkeit ist, desto größer wird die tatsächliche Wahrscheinlichkeit für den Zustand. Wenn es viele Realisierungsmöglichkeiten gibt, und die alle gleich wahrscheinlich sind, wird der Zustand insgesamt wahrscheinlicher sein, als wenn es nur eine einzige Realisierungsmöglichkeit gibt.
Man kann also die Wahrscheinlichkeit W wieder als ein Maß für die Wahrscheinlichkeit des Auftretens eines Makrozustandes ansehen. Durch je mehr Mikrozustände der Makrozustand realisiert werden kann, desto größer wird die Wahrscheinlichkeit sein, dass er auch eintritt. Der Unterschied zwischen den beiden Wahrscheinlichkeiten ist nur ein konstanter Faktor. Da zusätzlich ein Logarithmus mit hineinspielt bedeutet das, dass die Konstante nur additiv ist.
Bei der Entropie, wo es in erster Linie auf Änderungen ankommt, spielt eine additive Konstante genauso wenig eine Rolle, wie bei der potentiellen Energie. Dort geht es ja auch wieder nur um Energiedifferenzen. Und es hängt lediglich davon ab, was für einen Referenzzustand man wählt. Also kann man letztlich dieselbe Interpretation aufrechterhalten, wenn man für die Wahrscheinlichkeit eine Zahl nimmt, die die Anzahl der mikroskopischen Realisierungsmöglichkeiten betrifft.
Das ist eine Zahl, die nie
Also, im Wesentlichen ist dann die Wahrscheinlichkeit
Das bezeichnet man aus Sicht der phänomenologischen Thermodynamik als den Dritten Hauptsatz.
Mit anderen Worten, am absoluten Nullpunkt ist die Entropie Null. Oder bei Annäherung an den absoluten Nullpunkt geht die Entropie gegen Null. Das ist eine willkürliche Festlegung des absoluten Betrages der Entropie. Der Rest verschiebt sich in entsprechender Weise, sodass alles zusammenpasst.
Es wird ersichtlich, dass obige Gleichung
Für thermisch isolierte Systeme gelten somit:


Wenn man diese statistische Interpretation zugrunde legt, bedeutet das letzten Endes, dass sich bei Zustandsänderungen in thermisch isolierten Systemen die Zustände nur in Richtung größerer thermodynamischer Wahrscheinlichkeit bewegen werden. Also Zustände, die ein größeres Chaos aufweisen.
Das ist natürlich weitestgehend eine statistische Betrachtungsweise. Denn in unserem Universum, einem weitaus größeren makroskopischen System, scheinen noch andere Gesetzmäßigkeiten eine Rolle zu spielen. Andernfalls würde ein stetig zunehmendes Chaos zwangsläufig zu einem Kollaps führen.
Dennoch ist es erkennbar, dass alle Lebewesen offene Systeme sind. Wir leben im wahrsten Sinne des Wortes vom Austausch mit unserer Umgebung. Wir sind keine thermisch isolierten Systeme, weder thermisch noch massenmäßig. Wir haben einerseits eine thermische Wechselwirkung, und anderseits haben wir einen Stoffwechsel in beide Richtungen. Sonst können wir nicht existieren und andere Lebewesen auch nicht. Dieser Stoffwechsel ist zudem eine Basis für unsere Existenz. Eine Ordnung geht immer auf Kosten der Umgebung.
⇦ Kapitel Kapitel ⇨
