So wie bei der potentiellen Energie, muss man sich bei der Betrachtung auf einen
Bezugspunkt beziehen, in diesem Fall einen Referenzzustand. Von diesem Punkt oder
Zustand ausgehend, betrachtet man im
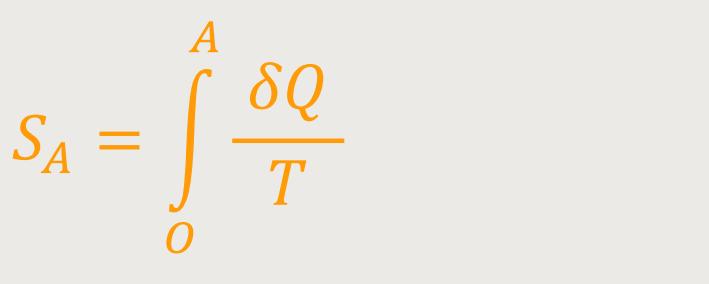
Das nennt man dann die Entropie des Zustandes A. Der Weg
Halten wir fest, die Entropie wird als eine Art Potential eingeführt, vergleichbar mit der potentiellen Energie in der Mechanik. Da gab es in ähnlicher Weise den Aspekt der Wegunabhängigkeit der Arbeit, und es wurde die Arbeit von einem Referenzpunkt bis zu dem betrachteten Punkt als potentielle Energie bezeichnet.
Jetzt haben wir wieder eine Wegunabhängigkeit, diesmal aber mittels Integral
Das ist genau das, was wir bereits im vorherigen Kapitel betrachtet haben. Diese
Man betrachtet anschließend im
Im Gegensatz zu den Wärmemengen, haben sich die reduzierten Wärmen wegkompensiert. Das heißt, nach einem solchen Zyklus ist das System wieder bei der gleichen Entropie angelangt. Anfänglich war diese Überlegung vielen Physikern mehr als suspekt. Und es hat Jahrzehnte gedauert, bis Boltzmann dann mit seiner statistischen Interpretation dem ganzen einen anderen Blickwinkel verliehen hat. Aber dazu kommen wir später noch.
Wir wollen noch einen weiteren wichtigen Punkt herausstellen, und zwar wenn man ein thermisch isoliertes System betrachtet. In einem solchen System werden die Wärmemengen ΔQ immer gleich Null sein. Es wird ja keine Wärme zugeführt und auch keine abgeführt. Insofern kann sich gerade wegen des reversiblen Prozesses auch die Entropie nicht ändern. Im Gegensatz zu den Wärmemengen hat die Entropie einen bestimmten Wert. Also gilt für die Wärmemengen:

Dementsprechend ergibt sich für die Entropie in reversiblen Prozessen:

Das ist nicht gleichbedeutend mit dem Wert „Null“, sondern damit soll lediglich ausgedrückt werden, dass sich beides in Summe nicht ändert, sondern vielmehr erhalten bleibt. Also, die Entropie ändert sich nicht bei reversiblen Prozessen in thermisch abgeschlossenen Systemen.
Wir wollen uns aber nicht nur auf reversible Prozesse beschränken. Wie verhält sich zum Beispiel ein irreversibler Prozess?
Als einen typischen irreversiblen Prozess betrachtet man insbesondere den Jouleschen Expansionsversuch.
Hierzu denkt man sich wieder einen zylindrischen Behälter, der mit wärmeisolierendem Material umgeben ist, also ein thermisch isoliertes System. Im Zylinder befindet sich eine Abtrennung mit einem Ventil, welches man schließen und öffnen kann. Durch die zwei Kammern ergibt sich ein Volumen V₁ und V₂. Zunächst befindet sich nur im Volumen V₁ ein ideales Gas. Dann wird das Ventil geöffnet, und das Gas strömt hinüber in das andere Volumen V₂. Das geschieht solange, bis der Druck in beiden Kammern ausgeglichen hat. Da bei diesem Zylinder jetzt kein Kolben vorhanden ist wird somit auch keine Arbeit geleistet.
Die experimentelle Erfahrung zeigt, dass bei freier Expansion keine Temperaturänderung zu verzeichnen ist. Somit ändert sich auch nicht die innere Energie, denn die ist ja von der Temperatur abhängig. Halten wir fest, hier ändert sich weder die Temperatur noch die innere Energie. Zudem hat man hier einen irreversiblen Prozess.
Denn wenn sich das Gas verteilt hat, und man anschließend das Ventil wieder schließt, bleibt der neue Zustand erhalten. Also auch hier sieht man, das funktioniert nur in eine Richtung. Könnte man allerdings einen Kolben verschieben, dann wäre es möglich, den ursprünglichen Zustand zu erhalten. Das ist ein ganz entscheidender Unterschied. Aber uns interessiert ja insbesondere, wie es um die Entropie steht? Bisher war sie nur definiert für reversible Prozesse.
Wir können bei unserem gedachten Experiment eine Erweiterung vornehmen. Statt ein Ventil zu öffnen, führen wir einen Ersatzprozess durch. Wir schieben jetzt statt des Ventils einen Kolben herüber, und führen so viel Wärmemenge zu, dass auch die Temperatur konstant bleibt. Also das System verrichtet dann Arbeit, aber es soll eine isotherme Expansion sein.
Wenn sich in dem System ein Kolben wegbewegt, dehnt sich das Gas aus. Die Moleküle trommeln zwar nach wie vor an die Kolbenfläche, aber die Energie wird kleiner. Dementsprechend wird auch die Temperatur abnehmen. Um die Temperatur aber konstant zu halten, muss von außen eine Wärmemenge ΔQ zugeführt werden. Es muss betragsmäßig genau so viel Wärmemenge ΔQ zugeführt werden, wie Arbeit −ΔW verrichtet wird.
Letzten Endes kommt man bei dem Ersatzprozess ebenfalls auf das Gesamtvolumen
Wenn also die zugeführte Wärmemenge gleich der abgeführten Arbeit ist, bedeutet das:
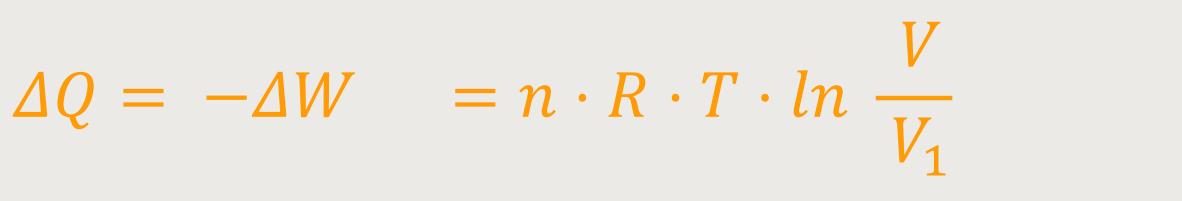
Die Wärmemenge ΔQ, die man bei diesem reversiblen Ersatzprozess hineinsteckt, führt zum gleichen Endzustand. Wenn aber die Entropie wirklich eine Zustandsgröße ist, dann muss sie für das expandierte System mit dem Kolben den gleichen Wert haben, wie bei dem System mit dem Ventil. Da jetzt das System reversibel ist, lässt sich die Entropieänderung des Ersatzprozesses ermitteln.
Da die Entropieänderung und die Änderung der Wärmemenge miteinander in Beziehung stehen, brauchen wir beides nur durch die Temperatur dividieren, und erhalten damit:
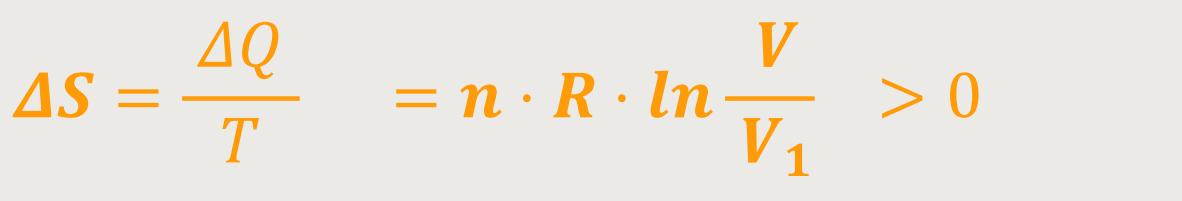
Damit erhält man eine Entropieänderung
Bei einem thermisch isolierten System ist die Wärmemenge ΔQ
immer Null. Dann müsste ja
Das heißt, wenn ΔS = 0 ist, gilt das nur für reversible Prozesse in thermisch abgeschlossenen Systemen. Wenn man dagegen einen irreversiblen Prozess hat, kann man die Entropie auf diese Weise nicht ermitteln. Obwohl der gleiche Endzustand durch einen reversiblen Ersatzprozess erreicht werden kann. Man muss halt nur einen Kolben langsam herausschieben, und gleichzeitig die notwendige Wärmemenge ΔQ hinzufügen, um letztlich durch isotherme Expansion den gleichen Endzustand wie beim Beispiel mit dem Ventil zu erreichen. Daher muss die Berechnungsgrundlage für die Entropieänderung ΔS richtig sein, weil hier ein reversibler Prozess die Grundlage bildet.
Und wenn man einen irreversiblen Prozess hat, muss man trotzdem auf das Gleiche
ΔS kommen. Daraus folgt:
Demnach gilt für irreversible Prozesse, dass die Entropieänderung nicht
Doch wenn die Entropie immer nur größer werden kann, dann steuert das Universum einer merkwürdigen Endsituation zu. Wenn dem so wäre, wie zahlreiche Physiker und Astronomen befürchten, hätten wir auf Dauer keine Zukunft. Hier spielt jetzt die Boltzmannsche Interpretation eine wesentliche Rolle, zu der wir im nächsten Kapitel noch kommen. Dann wird man verstehen, was diese aus praktischen Erwägungen wie ein Potential eingeführte Größe „S” für eine wichtige fundamentale Bedeutung hat.
Nun noch ein paar Schlussworte zum Begriff „Entropie”.
Der Begriff kommt vom griechischen entripain, und heißt so viel wie umdrehen. Die Entropie hat etwas damit zu tun, ob man etwas umdrehen kann, also ob ein Prozess reversibel ist, sprich ob man einen Ausgangszustand noch einmal erreichen kann. Strenggenommen sagt die Thermodynamik, die Entropie nimmt immer zu, also die Fähigkeit etwas umzudrehen wird immer kleiner und kleiner.
Die Entropie ist aber ein Spezialaspekt der Thermodynamik und hat mit einer Vielzahl von Möglichkeiten zu tun. Ein geordneter Zustand hat eine niedrige Entropie. In den vorherigen Beispielen haben wir ja gesehen, dass man nach Mischen eines Mediums nie wieder den geordneten Anfangszustand erreichen kann. Jeder Zustand, der danach kommt ist eine weitere Möglichkeit. Und weil die Möglichkeiten der Unordnung viel größer sind als die Möglichkeiten der Ordnung, vergrößert sich theoretisch die Entropie.
Die Entropie ist eine sogenannte extensive Größe. Sie hängt mit der wirklichen Ausdehnung eines Systems zusammen. Wenn das Universum ständig expandieren würde, vergrößert sich zwangsläufig die Entropie. Sie ist demnach riesig und wird in Zukunft noch größer werden. Ein Zustand der geordnet ist, ist demnach ein Zustand niedriger Entropie. Und ein Zustand der ungeordnet ist, ist ein Zustand hoher Entropie. Der Zweite Hauptsatz, nämlich dass die Entropie immer zunimmt, gilt nur für irreversible Systeme. Also Systeme die von der Umwelt thermisch isoliert sind. Die Erde ist dagegen nicht von der Umwelt abgeschlossen. Sie ist quasi ein kosmischer Durchlauferhitzer.
Die Sonne ist mit ihren etwa
Entropie hat auch etwas mit Information zu tun. Je geordneter ein Zustand ist, umso mehr Information enthält er. Die Entwicklung von Molekülen ist daher etwas ganz besonderes. Aber thermodynamisch gesprochen ist das nur eine Winzigkeit. Um sich vorzustellen, was es mit den Informationen auf sich hat, gibt es einen schönen Vergleich:
Hierzu betrachtet man ein Glas Bier mit etwas Schaum obendrauf. Schaum scheint auf den ersten Blick etwas völlig Ungeordnetes zu sein. Demnach müsste Schaum ein Zustand hoher Entropie sein. Nach einiger Zeit ist der Schaum wieder weg, und man sieht nur noch die klare Flüssigkeit. Alles sieht jetzt sehr schön geordnet aus. Diese Annahme ist aber ein Trugschluss. Der Schaum zerfällt zwar zu Flüssigkeit. Der Grund ist aber, dass die Entropie bei diesem Schaumzerfall in Form von Flüssigkeit zunimmt. Der Schaum, insbesondere die Blasenwände, sind Zwangsbedingungen an das System. Das heißt, im Schaum sind eigentlich mehr Informationen enthalten, als in der Flüssigkeit.
Im Schaum können sich die Moleküle nur in den Blasenwänden bewegen, wogegen sie sich in der Flüssigkeit völlig frei bewegen können. Das heißt, die Anzahl der Bewegungsmöglichkeiten sind in einer Flüssigkeit viel größer, als die Möglichkeiten in einer Schaumblase. Entropie hat also strenggenommen viel damit zu tun, welche Zwangsbedingungen in einem physikalischen System vorherrschen. Was also Ordnung ist und was Unordnung ist, lässt sich in vielen Fällen nicht immer eindeutig erkennen. Und so ziehen Physiker und Astronomen oft vorschnelle Schlussfolgerungen, ohne vielleicht den gesamten Zusammenhang zu kennen.
Klar ist aber, dass bei offenen Systemen, also Systemen, die nicht isoliert sind, Energie zufließt und auch wieder abgegeben wird. Als Menschen nehmen wir zum Beispiel entropiearme Dinge auf, und geben entropiereiche Dinge wieder ab. Aber in geschlossenen Systemen nimmt die Entropie immer zu. Um dennoch eine Entropiereduktion zu erreichen, muss Energie zugeführt werden. Eine Gleichverteilungssituation ist eine Situation höchster Entropie, also geringster Information. In dem Moment aber, wo Energie in das System reinkommt, gibt es auf einmal die Möglichkeit, die Entropie zu verringern.
Allerdings muss dann die Energie von außen kommen. Erst dann kann das System im Innern eine niedrigere Entropie haben. Damit ist auch klar, wie im Universum überhaupt etwas entstehen kann. Es gibt eine äußere Energiequelle, im Allgemeinen spricht man von einer Art Gravitationspotential, die alles strukturiert.
Ausgehend von einem Urknall würde wahnsinnig viel Entropie erzeugt. Denn ein riesiges Volumen, aus dem das Gas ursprünglich kam, war daran beteiligt. Darüber hinaus muss eine Insel mit einer niedrigeren Energie erzeugt werden, in einem Meer von Unordnung. Und weil im Großen und Ganzen ständig alles zerfällt, vertreten einige die Auffassung, dass die Entropie nur anwendbar sei in einem klaren physikalisch gegebenen Sinne. Anders solle man den Begriff nicht verwenden. Entropie wäre eine physikalische Aussage über die Anzahl der Möglichkeiten in einem physikalisch gewählten Raum.
⇦ Kapitel Kapitel ⇨
