Flüssigkeiten unterscheiden sich, was die „Stromleitung” angeht, erheblich von metallischen Leitern. Hier spielt keine elektronische Leitung eine Rolle, sondern eine Ionenleitung ist vorherrschend. Das heißt, es bilden sich in einer Flüssigkeit positive und negative Ionen. Und damit wird aus der Flüssigkeit ein Elektrolyt. Was versteht man im Einzelnen darunter?
Wenn man in ein Trägermedium, vornehmlich Wasser, bestimmte Substanzen zusetzt, können die Moleküle je nach ihrer Bindung zu Ionen zerfallen. Es gibt unterschiedliche Arten von Bindungen. Man spricht hier von „heteropolaren Bindungen” und den „Valenzbindungen”. Durch das Überlappen der Elektronenhüllen kommt es zu festgebundenen Atomen, bzw. zu einem Molekül. Man kann davon ausgehen, dass die Moleküle eine stabile Struktur annehmen.
Dann gibt es noch andere Bindungen, die sogenannten „Ionenmoleküle”, wie zum Beispiel das Kochsalz. Bei derartigen Substanzen, werden die Bestandteile, in diesem Fall Natrium und Chlor, nur durch elektrostatische Wechselwirkung zusammengehalten. Die Verbindung besteht aus einem positiven Natrium-Ion und einem negativen Chlor-Ion. Kommt ein solches Molekül mit Wasser in Verbindung, wird es seine Bindung verlieren. Das liegt daran, dass Wasser eine hohe „Dielektrizitätskonstante” hat, wodurch sich im Innern des Wassers die elektrischen Kräfte um den Faktor 80 reduzieren. Daher geht die Anziehungskraft zwischen Natrium und Chlor dramatisch zurück, und aufgrund der thermischen Bewegungen wird eine Mehrzahl der Natriumchlorid-Moleküle dissoziieren. Die Moleküle zerfallen in positive Natrium-Ionen und negative Chlor-Ionen.
Als Folge der Dissoziation wird Kochsalz Ladungsträger bilden. Der Umstand, dass verschiedene Moleküle (Zucker oder Salz) unterschiedlich reagieren, lässt sich durch Experimente bestätigen. Entscheidend ist vor allem, dass insbesondere bei heteropolaren Molekülen, bei denen die Partner von vornherein unterschiedliche Ladungen tragen, in einer Wasserlösung bevorzugt dissoziieren und dadurch positive und negative Ionen bilden. Die Ionen bleiben anschließend aber nicht getrennt voneinander erhalten, denn Wasser hat noch eine weitere wichtige Eigenschaft. Die Wassermoleküle haben nämlich ein relativ ausgeprägtes elektrisches Dipolmoment.
Grafik (wird später eingefügt)
Die Ionen sind zunächst umgeben von Wassermolekülen, die sich an den unterschiedlichen Ladungen anlagern. Das bezeichnet man auch als „Hydratisierung”. Sinn und Zweck eines Elektrolyten ist es aber, dass es zu einer Wanderung der Ionen in einer flüssigen Lösung kommt. Hierzu werden „Elektroden” in die Flüssigkeit hineingehängt, und anschließend in dem Elektrolyten ein elektrisches Feld generiert. Als Folge davon wandern die positiven Ionen in die eine Richtung und die negativen Ionen in die andere Richtung. Und weil sich Wassermoleküle angelagert haben, ziehen die Ionen die ganze Hydratisierungsschicht mit sich, und sind deshalb nicht besonders beweglich.
Die Elektroden sind metallische Körper, an die eine Spannung angelegt wird. Die Elektrode, an der man den Pluspol anlegt, wird als „Anode” bezeichnet, und der Minuspol ist die „Kathode”. Und daraus ergeben sich dann auch die Bezeichnungen für die Ionen. Als Kationen (+) bezeichnet man die Ionen die sich zur negativen Kathode bewegen und als Anionen (-) die Ionen, die sich zur positiven Anode bewegen. Und wenn die Stromleitung in einem solchen Elektrolyten stattfindet, bewirkt das verschiedene Effekte. Zum einen tritt eine chemische Zersetzung des Elektrolyten ein. Und es kommt es einem Massentransport der Ionen, die sich an den Elektroden ablagern. Inwieweit sich die Elektroden letztlich zersetzen, hängt von deren Material ab.
Wenn man sich den „Massentransport in Elektrolyten” quantitativ anschaut, definiert man sich zunächst ein paar Größen.
Ionen haben eine Masse μ, und natürlich haben sie auch eine bestimmte Ladung. Das wird entweder nur eine Elementarladung oder eine ganzzahlige Anzahl von Elementarladungen sein. Bei verschiedenen Substanzen kann es zu doppelt und dreifach geladenen Ionen kommen. Also ein vielfaches der Elementarladung. Und damit ist die Ladung eine feste Größe:

z ist ein ganzzahliger Wert
e ist die Elementarladung
Zusätzlich möchte man eine wohldefinierte Ionenlösung haben. Entweder ein Natriumchlorid, Bleiazetat oder Silbernitrat usw., denn erst dann lässt sich bestimmen, wie groß der Wert z sein wird. Im Laufe einer Elektrolyse werden eine bestimmte Anzahl von Ionen ΔN abgeschieden. Diese Abscheidung hat einiges zur Folge. Einerseits bedeutet es einen Massentransport:

Andererseits wird eine gewisse Ladung dabei abgegeben:

Damit erhält man eine Aussage über die Anzahl der Ionen:
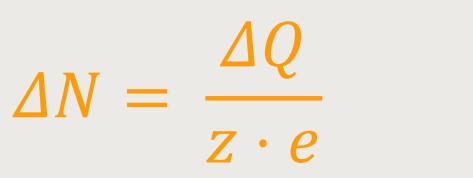
Wenn durch den Elektrolyten ein Strom fließt, kann man den Strom mit einem Amperemeter messen. Und wenn man weiß, wie lang der Strom fließt, erhält man die Ladung:
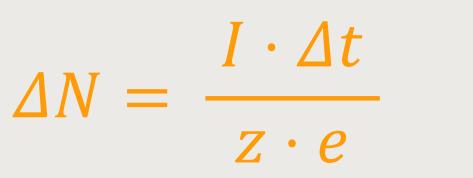
Vorausgesetzt natürlich, dass der Strom gleichmäßig fließt. Und daraus kann man die abgeschiedene Masse bestimmen:
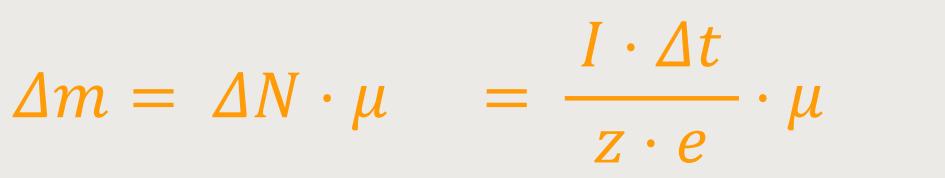
Experimentell lässt sich die Stromstärke I bestimmen und auch die Zeit Δt messen. Die anderen Werte fasst man zunächst in die Konstante kf zusammen. Daraus ergibt sich dann für den Massentransport:

Diese Beziehung wird als das 1. Faraday-Gesetz bezeichnet.
Die abgeschiedene Masse ist somit proportional zur Stärke des fließenden Stroms und proportional zur verstrichenen Zeit. Und die Proportionalitätskonstante kf kann man ablesen. Diese Konstante ist zunächst ein empirisch ermittelter Wert, und entspricht dann:
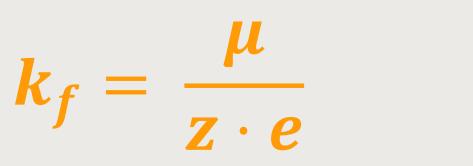
Die Konstante wird als das 2. Faraday-Gesetz bezeichnet.
Auf diese Art und Weise hat man die Möglichkeit, aus der experimentellen Bestimmung einen Rückschluss auf die Eigenschaften der Ionen zu ziehen. Wenn man zum Beispiel die Masse des jeweiligen Ions kennt, kann man daraus die Ladungszahl z der Ionen, die bei diesem Leitungsvorgang wirksam sind, bestimmen.
Des Weiteren kann man die Größen μ und e mit der „Avogadrozahl” multiplizieren:
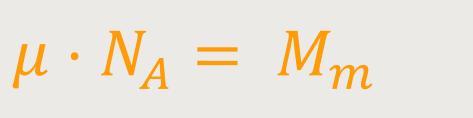
Mm ist das Molekulargewicht der entsprechenden Ionen
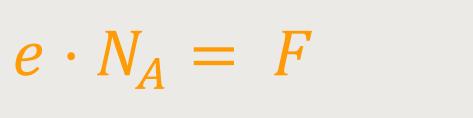
F ist hier die Faraday-Konstante
Damit erhält obige Beziehung noch eine etwas andere Form:

Auf diese Weise kann man entweder bei bekannter Ladung der Ionen, das Molekulargewicht ermitteln oder umgekehrt. Damit ergibt sich eine praktische Möglichkeit, Eigenschaften der Moleküle und der Ionen aus quantitativen makroskopischen Messungen zu erhalten.
Ein weiterer wichtiger Punkt bei der Elektrizitätsleitung in Flüssigkeiten ist die Leitfähigkeit ? .
Sie wurde bereits definiert als:

ϱ ist die Ladungsdichte
v ist die mittlere Driftgeschwindigkeit der Ladungsträger
n ist die Ladungsträgerkonzentration
Die Ladungsträgerkonzentration ist die Anzahl der Ladungsträger pro Volumeneinheit. Die mittlere Driftgeschwindigkeit hängt zusammen mit der wirkenden elektrischen Feldstärke. Aber natürlich spielt auch die Beweglichkeit der entsprechenden Ionen eine Rolle, also wie groß zum Beispiel die Hydratisierungsschicht um die Ionen ist. Diese Driftgeschwindigkeit lässt sich abschätzen mit Hilfe einer empirisch ermittelten Größe:

u ist die Ionenbeweglichkeit
Generell versteht man unter der Beweglichkeit eine Größe die, wenn man sie mit
der wirkenden Kraft multipliziert, die Geschwindigkeit ergibt. In der Hydrodynamik
zäher Medien war es beim Stokes'schen Gesetz ähnlich. Dieses Gesetz war definiert
als:
E ist die Kraft auf die Ladungseinheit
Wenn man das jetzt in obige Beziehung einsetzt, erhält man:
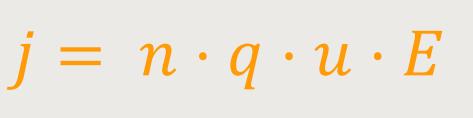
Anderseits gilt laut Ohm'sches-Gesetz:

Hierbei muss man jetzt auf die vektoriellen Eigenschaften keine Rücksicht nehmen, weil sowohl die Geschwindigkeit, als auch der Massefluss nur in eine Richtung verläuft.
Und damit kann man jetzt die Leitfähigkeit des Elektrolyten σ bestimmen:
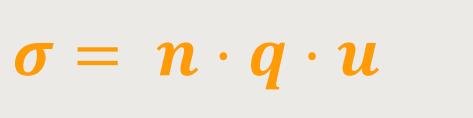
q ist die Ladung eines Ladungsträgers
u ist die Beweglichkeit
Je größer die Ladungsträgerkonzentration, desto besser wird der Elektrolyt leiten. Aus diesem Grund leitet eine Salzlösung auch besser als eine Zuckerlösung. Das liegt daran, weil die Zuckermoleküle schlechter im Wasser dissoziieren. Bei Salz dagegen erhält man eine viel größere Anzahl von Ladungsträgern und damit eine hervorragende Leitfähigkeit. Die Ladung ist ein ganzzahliges Vielfaches der Elementarladung.
(Hinweis: Bei Natrium-Chlorid ist z = 1, denn Natrium hat nur eine positive Ladung und das Chlor hat nur eine negative Ladung.)
Nun ist man daran interessiert, dass der Elektrolyt möglichst gut leitet. Also gibt man möglichst viele Ladungsträger in die Lösung, bis diese gesättigt ist. Und wenn die „Ladungsträgerkonzentration” n steigt, wird auch die Leitfähigkeit σ zunehmen. Und damit wird letztlich auch die Stromstärke zunehmen.

Es zeigt sich aber, dass diese Gesetzmäßigkeit für große Ladungsträgerkonzentrationen n nicht zutrifft. Denn was wir bisher betrachtet haben, waren alles Einzeleffekte bezogen auf ein einzelnes Ion, insbesondere wenn dieses unter dem Einfluss eines Feldes steht. Oder wenn es Reibung mit der Umgebung des Elektrolyten kommt. Denn wenn sehr viele Ionen in der Lösung vorhanden sind, beginnen sich diese kollektiv zu stören. Die positiven Ionen stören die negativen Ionen. Neben dem Einzeleffekt gibt es somit auch einen Kollektiveffekt. Dadurch kommt es zu einer Kraftwirkung zwischen den unterschiedlich geladenen Ionen und somit zu einer sinkenden Ionenbeweglichkeit.

Wenn die Temperatur anzeigt, nimmt im Allgemeinen auch die Beweglichkeit der Ionen zu. Denn durch die größere Bewegung der Flüssigkeitsmoleküle sind die Zwischenräume durchlässiger für die Ionen.

Wenn aber die Temperatur ansteigt, wird auch die thermische Bewegung intensiver, und dadurch kommt es zu stärkerer Dissoziation und stärkerer Ladungstrennung. In diesem Fall erhöht sich die Ladungsträgerkonzentration.

Die höhere Beweglichkeit und die höhere Ladungsträgerkonzentration bewirken ihrerseits eine Erhöhung der Leitfähigkeit.

Also, mit der Temperatur steigt die Leitfähigkeit im Elektrolyten. Bei den metallischen Leitern ist es genau entgegengesetzt.
Was passiert, wenn man zum Beispiel als Elektrolyt eine Schwefelsäurelösung H₂O+H₂SO₄ verwendet?
Eine Schwefelsäurelösung hat eine gewisse chemische Aggressivität. An den zwei Elektroden, Cu (Kupfer) und Zn (Zink) erfolgt eine unterschiedlich starke Anlösung. Es gehen positive Metall-Ionen „in Lösung”. Und je mehr Ionen das Metall freigibt, desto unedler ist es. Damit wird die unedlere Elektrode der negative Pol sein und die edlere Elektrode der positive Pol. Also, durch das in Lösung gehen ergibt sich eine Potenzialdifferenz Δϕ = U zwischen der jeweiligen Elektrode und dem Elektrolyten.
Als Folge davon reichert sich um jede Elektrode herum ein unterschiedlicher Elektrolyt an, denn jede Elektrode hat durch dieses in Lösung gehen eine Potentialdifferenz gegen den Elektrolyten, der seinerseits auf gleichem Potenzial ist. Die eine Differenz wird höher ausfallen als die andere:
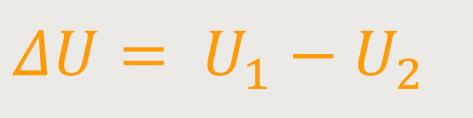
Allerdings sind die beiden Einzelspannungen nicht separat messbar. Es lässt sich nur die Gesamtdifferenz mit einem Spannungsmessgerät messen.
Und so lässt sich auch wieder eine Spannungsreihe zusammenstellen, zwischen solchen Materialien, die sich als positive oder negative Elektrode eignen. Die Reihe verläuft von unedel zu edel. Das ist jetzt aber die „galvanische Spannungsreihe”, denn hierbei geht es darum, wie leicht die Metall-Ionen in Lösung gehen.
(negativ) Li − K − Na − Zn
... Fe ...
Cu − Ag − Au (positiv)
Auf diese Art und Weise lässt sich die galvanische Spannungsreihe dazu verwenden, das Verhalten von galvanischen Elementen, und damit von Batterien, vorherzusagen.
⇦ Kapitel Kapitel ⇨
